Уровень pH - мера кислотности водных растворов. Измерение и регулирование pH важно для контроля качества и процессов в химии, биологии, медицине и других областях. Узнайте о влиянии pH на кожу и его важности для поддержания ее здоровья и защитных функций.
Cодержание
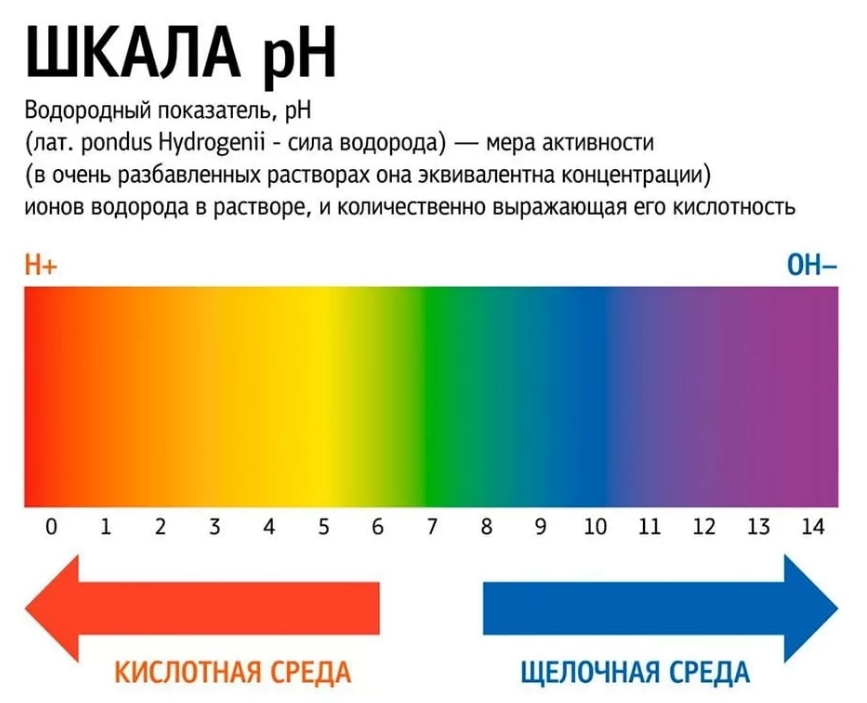
Водоро́дный показа́тель (pH) — мера кислотности водных растворов. Он является способом выражения активности катионов водорода в растворах. Противоположен по знаку и равен по модулю десятичному логарифму активности катионов водорода (Н+), выраженной в молях на литр, которую в сильно разбавленных растворах можно считать равной их равновесной молярной концентрации ([H+]).

История
Понятие pH было введено в 1909 году датским химиком Сёренсеном. Показатель называется pH, по первым буквам латинских слов potentia hydrogenii — сила водорода, или pondus hydrogenii — вес водорода.
Определение pH
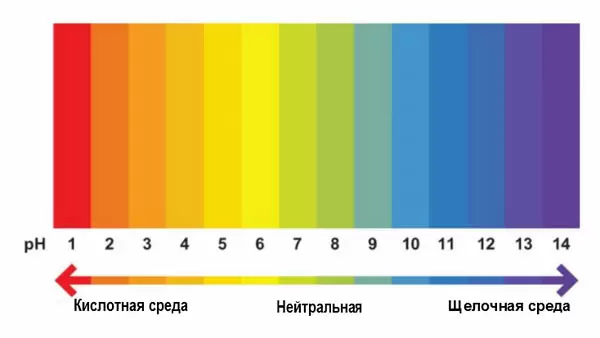
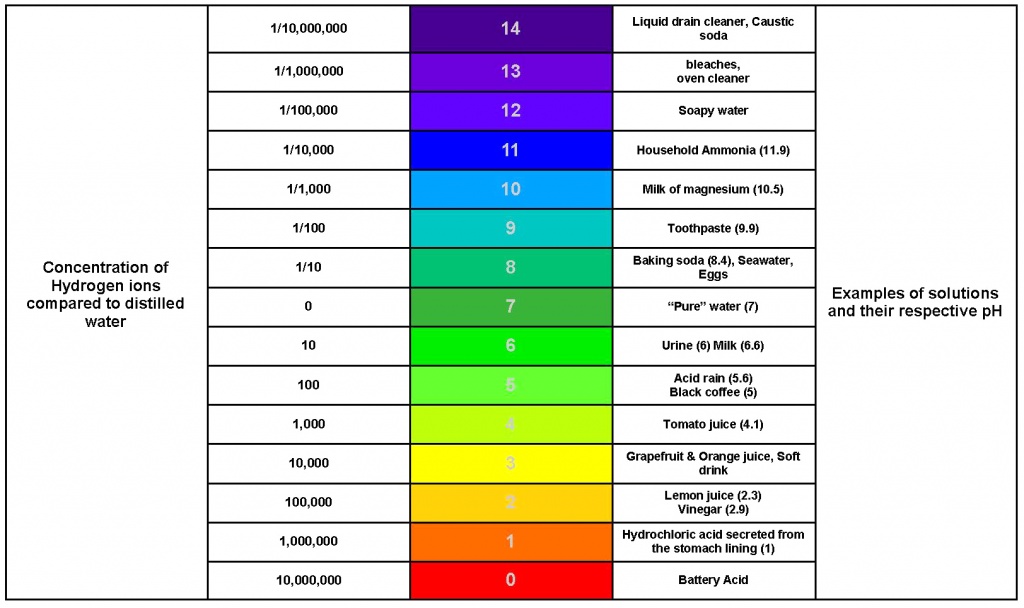
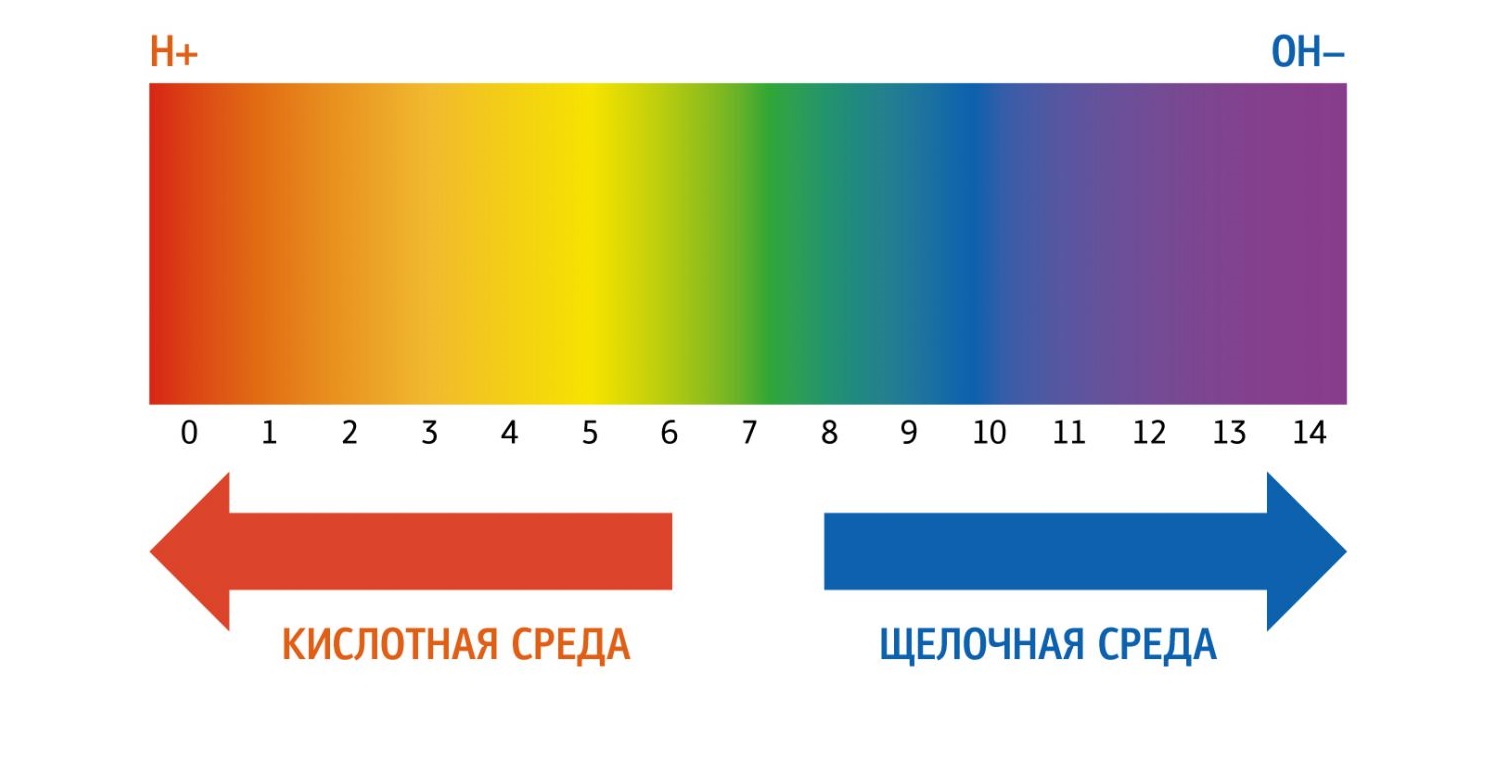
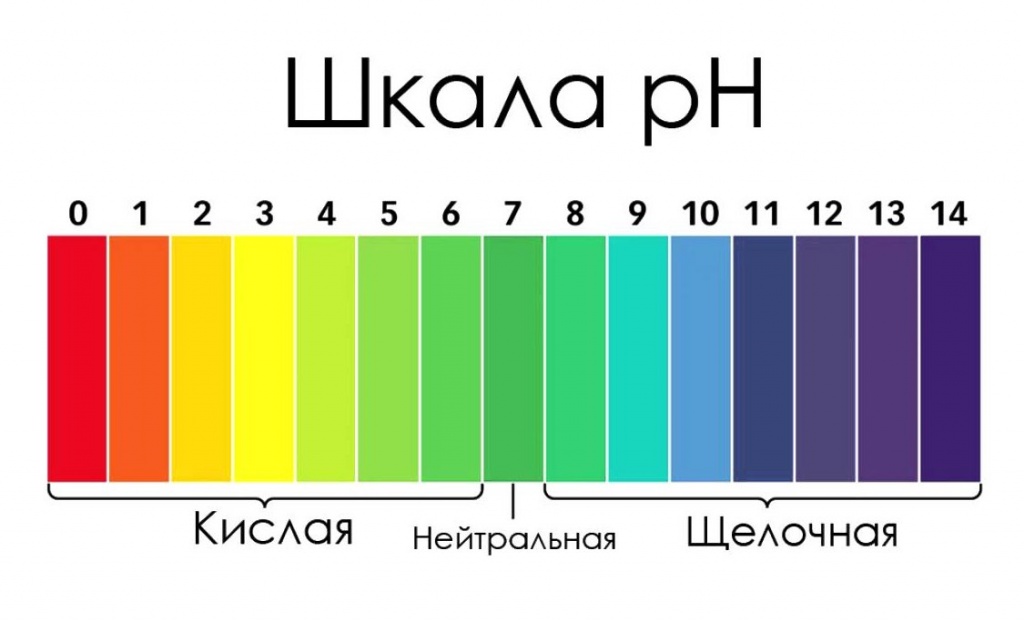
В чистой воде концентрации ионов водорода ([H+]) и гидроксид-ионов ([OH−]) одинаковы и при 22 °C составляют по 10−7 моль/л. Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается. При добавлении основания происходит повышение содержания гидроксид-ионов и падение концентрации ионов водорода. Когда [H+] > [OH−], говорят, что раствор является кислотным, а при [OH−] > [H+] — основным.
Для удобства представления, используется взятый с обратным знаком десятичный логарифм концентрации ионов водорода, который и является водородным показателем pH.
См. также
Измерение pH
Водородный показатель может быть определён с помощью кислотно-основных индикаторов или измерен с помощью потенциометрического pH-метра.

Важность измерения pH
Точное измерение и регулирование pH необходимо в различных отраслях химии, биологии, наук о материалах, технологий, медицины и агрономической химии. pH играет важную роль в контроле качества и процессах, связанных с реакциями кислот и оснований.

Нормальный pH кожи
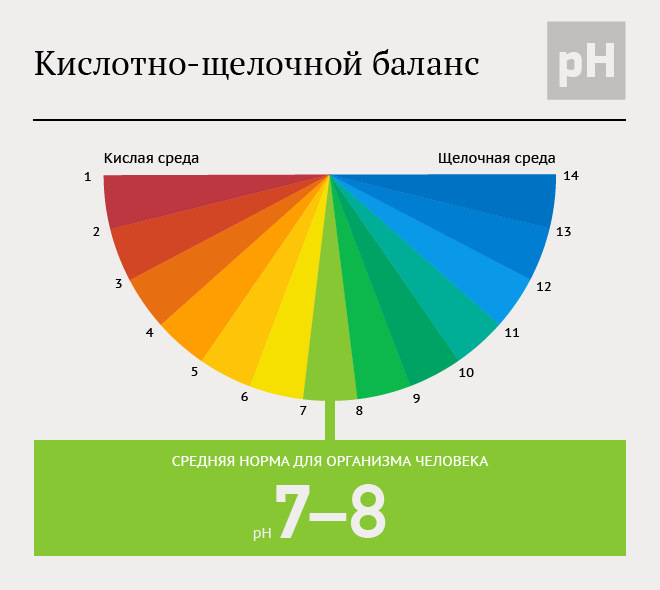
pH кожи является индивидуальным для каждого человека и может колебаться даже для разных участков тела одного человека. В среднем, pH кожи человека составляет 5,5, что указывает на ее слабокислую реакцию. Эта кислотная мантия на поверхности кожи служит естественным барьером и защищает организм от воздействий микроорганизмов.
Кислотно-щелочной баланс кожи зависит также от типа кожи. Сухая кожа имеет более кислую реакцию (от 3 до 5,2), в то время как жирная кожа имеет реакцию около 5,7-7. Нормальный тип кожи обычно имеет pH около 5,5.
Изменение pH кожи может влиять на ее состояние и здоровье. Поддержание нормального pH кожи является важным аспектом для поддержания ее защитных функций и предотвращения различных проблем, таких как сухость, раздражение и акне.
См. также
Влияние факторов на pH кожи
Факторы, влияющие на pH кожи, могут быть эндогенными и экзогенными.
Эндогенные факторы:
- Этнические различия
- Возраст
- Половая принадлежность
Экзогенные факторы:
- Очищающие и косметические средства
- Пот и кожное сало
- Рацион питания
Изменение этих факторов может влиять на pH кожи. Например, использование очищающих средств с высокой кислотностью может помочь восстановить нормальный кислотно-щелочной баланс кожи и снизить количество вредоносных бактерий.
Заключение
Уровень pH является важным показателем, который характеризует кислотность или щелочность водных растворов. Измерение и регулирование pH играют важную роль в различных областях науки и промышленности. На коже pH имеет особое значение, поскольку влияет на ее здоровье и состояние. Поддержание нормального pH кожи является ключевым фактором для поддержания ее защитных функций и предотвращения различных проблем.

Что нам скажет Википедия?
Водоро́дный показа́тель (pH [пэ-аш] ← лат. pondus Hydrogenii «вес водорода») — мера кислотности водных растворов. Является способом выражения активности катионов водорода в растворах. Противоположна по знаку и равна по модулю десятичному логарифму активности (а) катионов водорода (Н+), выраженной в молях на литр, которую в сильно разбавленных растворах можно считать равной их равновесной молярной концентрации ([H+]).
Для водных растворов (при стандартных условиях):
- Водородный показатель может быть определён с помощью кислотно-основных индикаторов, измерен потенциометрическим pH-метром.
- Точное измерение и регулирование pH необходимо в различных отраслях химии, биологии, наук о материалах, технологий, медицины и агрономической химии.
История
Это понятие было введено в 1909 году датским химиком Сёренсеном. Показатель называется pH, по первым буквам латинских слов potentia hydrogenii — сила водорода, или pondus hydrogenii — вес водорода. Вообще в химии сочетанием pX принято обозначать величину, равную -lg X. Например, силу кислот часто выражают в виде pKa = -lg Ka.
В случае pH буква H обозначает концентрацию ионов водорода (H+), или, точнее, термодинамическую активность гидроксоний-ионов.
Уравнения, связывающие pH и pOH
Вывод значения pH
В чистой воде концентрации ионов водорода ([H+]) и гидроксид-ионов ([OH−]) одинаковы и при 22 °C составляют по 10−7 моль/л, это напрямую следует из определения ионного произведения воды, которое равно [H+] · [OH−] и составляет 10−14 моль2/л2 (при 25 °C).
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается (на самом деле увеличивается не концентрация собственно ионов — иначе как способность кислот «присоединять» ион водорода могла бы приводить к этому — а концентрация именно таких соединений с «присоединённым» к кислоте ионом водорода), а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания — наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда [H+] > [OH−], говорят, что раствор является кислотным, а при [OH−] > [H+] — основным.
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентрации ионов водорода используют её взятый с обратным знаком десятичный логарифм, который, собственно, и является водородным показателем — pH.
pOH
Несколько меньшее распространение получила обратная pH величина — показатель осно́вности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH−:
Так как в любом водном растворе при 25 °C [H+] · [OH−] = 1,0 · 10−14, очевидно, что при этой температуре:
Значения pH в растворах различной кислотности
Так как при 25 °C (стандартных условиях) [H+] · [OH−] = 10−14, то понятно, что при этой температуре pH + pOH = 14.
Так как в кислотных растворах [H+] > 10−7, то у кислотных растворов pH < 7, аналогично, у осно́вных растворов pH > 7, pH нейтральных растворов равен 7. При более высоких температурах константа электролитической диссоциации воды повышается, соответственно увеличивается ионное произведение воды, поэтому нейтральной оказывается pH < 7 (что соответствует одновременно возросшим концентрациям как H+, так и OH−); при понижении температуры, напротив, нейтральная pH возрастает.
Связь pKa и pH
pKa = -lg(Ka) — показатель константы кислотности
Уравнение Гендерсона-Хассельбаха
pH = pKa + lg([A−]/)
Методы определения значения pH
Для определения значения pH растворов широко используют несколько методик. Водородный показатель можно приблизительно оценивать с помощью индикаторов, точно измерять pH-метром или определять аналитически путём, проведением кислотно-осно́вного титрования.
Влияние температуры на значения pH
Влияние температуры на значения pH объясняется различной диссоциацией ионов водорода (H+) и не является ошибкой эксперимента. Температурный эффект невозможно компенсировать за счет электроники pH-метра.
Роль pH в химии и биологии
Кислотность среды имеет важное значение для множества химических процессов, и возможность протекания или результат той или иной реакции часто зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований или на производстве применяют буферные растворы, которые позволяют сохранять практически постоянное значение pH при разбавлении или при добавлении в раствор небольших количеств кислоты или щёлочи.
Водородный показатель pH широко используется для характеристики кислотно-осно́вных свойств различных биологических сред.
Кислотность реакционной среды особое значение имеет для биохимических реакций, протекающих в живых системах. Концентрация в растворе ионов водорода часто оказывает влияние на физико-химические свойства и биологическую активность белков и нуклеиновых кислот, поэтому для нормального функционирования организма поддержание кислотно-осно́вного гомеостаза является задачей исключительной важности. Динамическое поддержание оптимального pH биологических жидкостей достигается благодаря действию буферных систем организма.
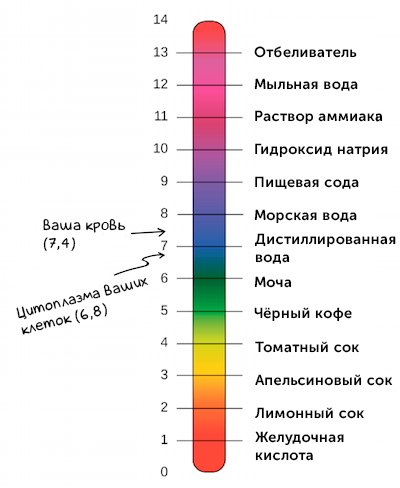
В человеческом организме в различных органах водородный показатель различен. Нормальный pH крови составляет 7,36, то есть кровь имеет слабоосновную реакцию (с колебаниями от 7,34 у венозной крови до 7,40 у артериальной). В зависимости от биохимических изменений в крови может наблюдаться ацидоз (увеличение кислотности) или алкалоз (увеличение осно́вности), однако совместимый с жизнью диапазон pH крови невелик, поскольку уже при уменьшении pH до 6,95 наступает потеря сознания, а смещение реакции крови в щелочную сторону до pH = 7,7 вызывает тяжелейшие судороги. Поддержание кислотно-основного баланса крови в допустимых пределах осуществляется буферными системами крови, главной из которых является гемоглобиновая. Нормальный водородный показатель желудочного сока (в просвете тела желудка натощак) равен 1,5…2,0. У сока тонкой кишки pH в норме составляет 7,2…7,5, при усилении секреции достигает 8,6. pH содержимого толстого кишечника может варьировать в норме от 6,0 до 7,2 единиц и зависит прежде всего от уровня продукции жирных кислот его микробиотой.
Примечания
Литература
Ссылки