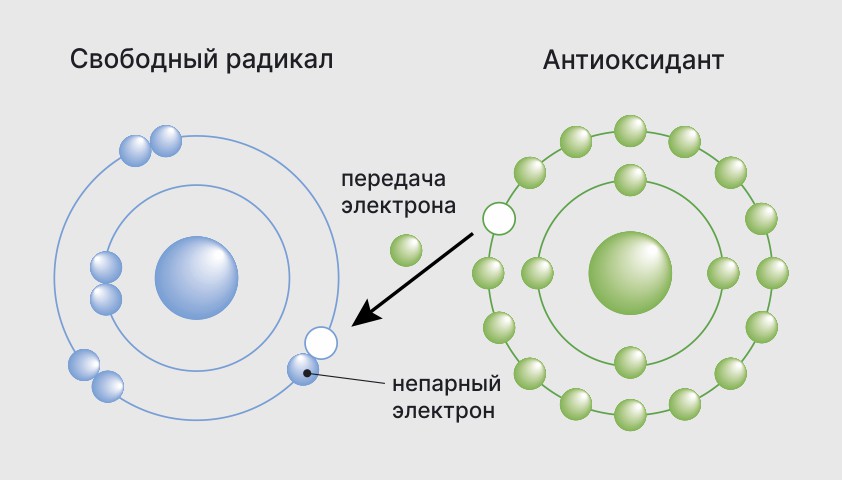
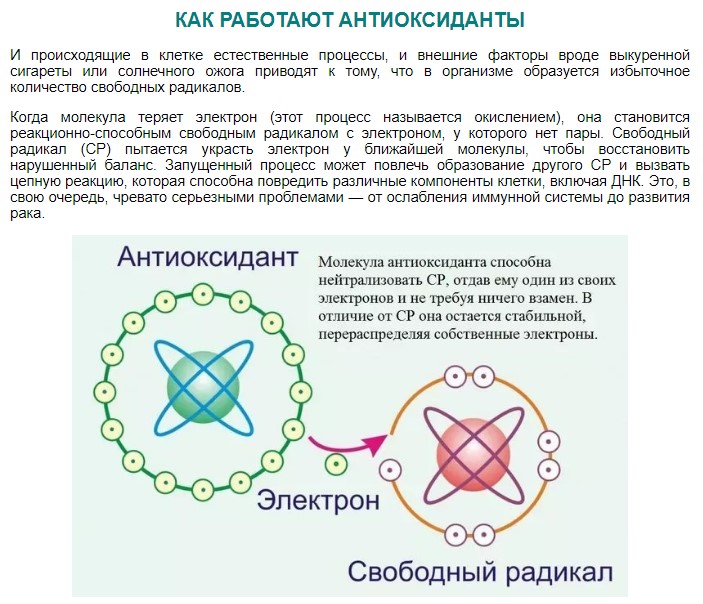
Свободные радикалы в химии – частицы, содержащие неспаренные электроны на внешней электронной оболочке. Они обладают высокой химической активностью и могут повреждать клетки и генетический код. Изучение свободных и стабильных радикалов важно для понимания химических процессов в организмах и разработки методов их контроля и предотвращения.
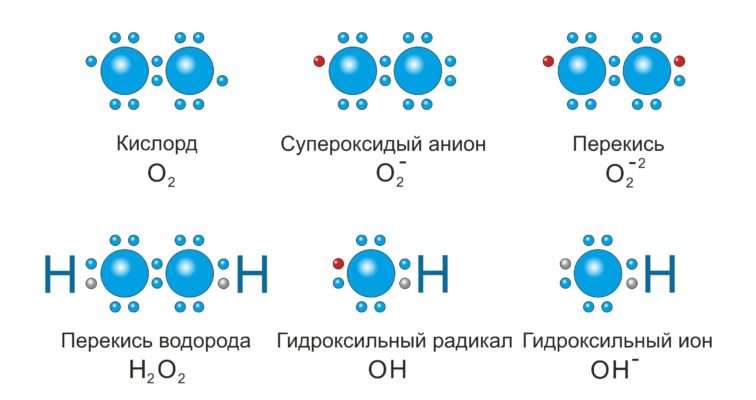
Свободные радикалы в химии – частицы, содержащие один или несколько неспаренных электронов на внешней электронной оболочке. Они могут быть твёрдыми, жидкими или газообразными веществами и существовать в течение различных временных промежутков – от очень короткого (доли секунды) до очень долгого (несколько лет). Свободные радикалы могут быть как нейтральными, так и ионными (ион-радикалы), а также иметь более одного неспаренного электрона, как, например, у бирадикалов. Они обладают парамагнитными свойствами и являются очень реакционноспособными частицами.

История открытия
Существование свободных радикалов было предположено ещё в XIX веке. В 1849 году Эдуард Франкленд и Герман Кольбе совершили ошибки в идентификации радикалов, например, приняв бутан за этильный радикал и этан за метильный радикал.
Первым свободным радикалом, обнаруженным в растворе, стал трифенилметильный радикал, найденный Мозесом Гомбергом в 1900 году. Он получил его действием серебра на трифенилметилхлорид. Раствор стал желтым, а затем выпали белые кристаллы димера радикала.
В 1929 году Фридрих Панет идентифицировал метильный и этильный радикалы. Он проводил эксперименты с разложением тетраметилсвинца в токе водорода и оценил время жизни радикалов в условиях опыта.
В 1930 году был получен порфирексид, первый стабильный нитроксильный радикал, однако исследователи не идентифицировали его как радикал.
Свойства свободных радикалов
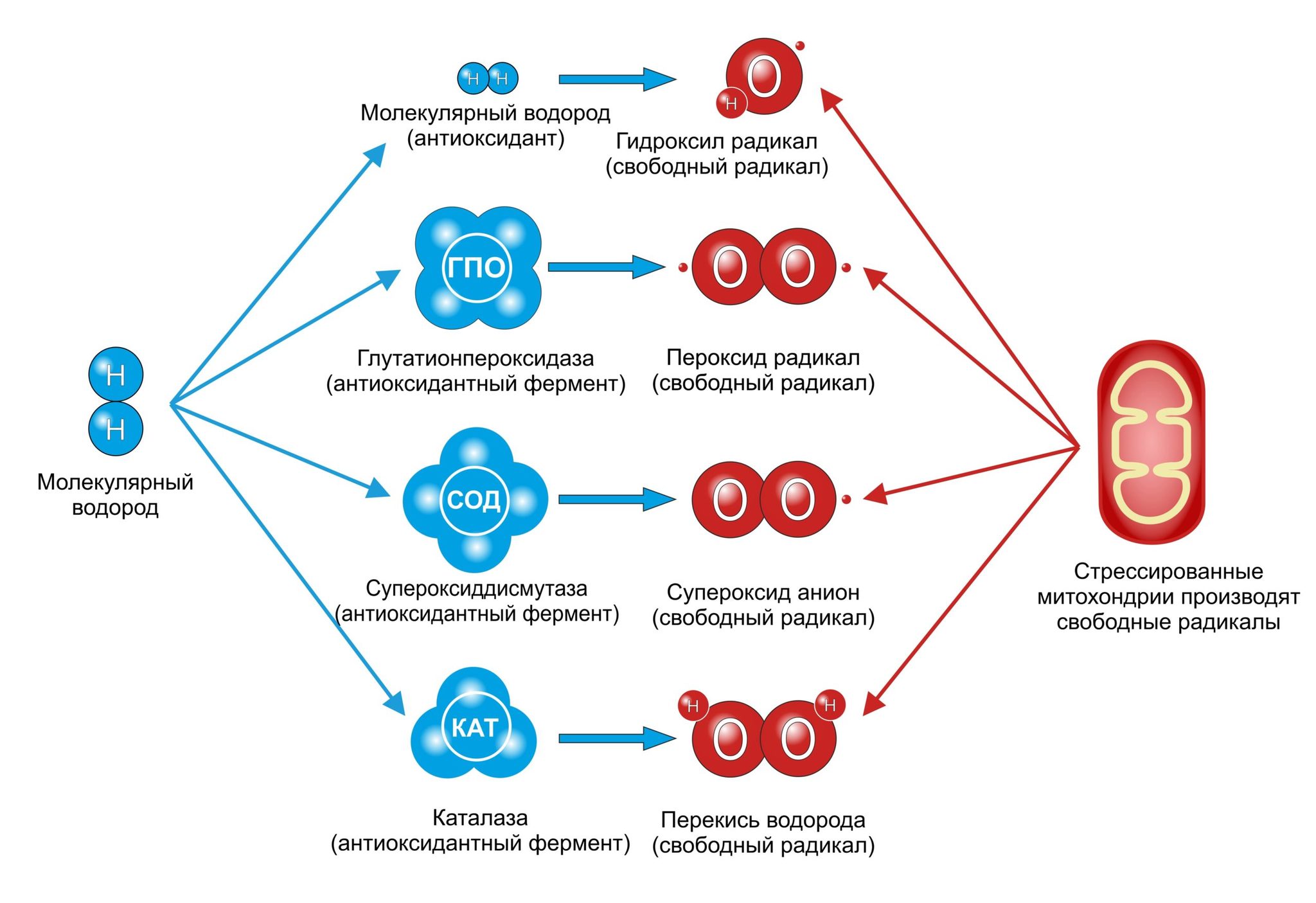
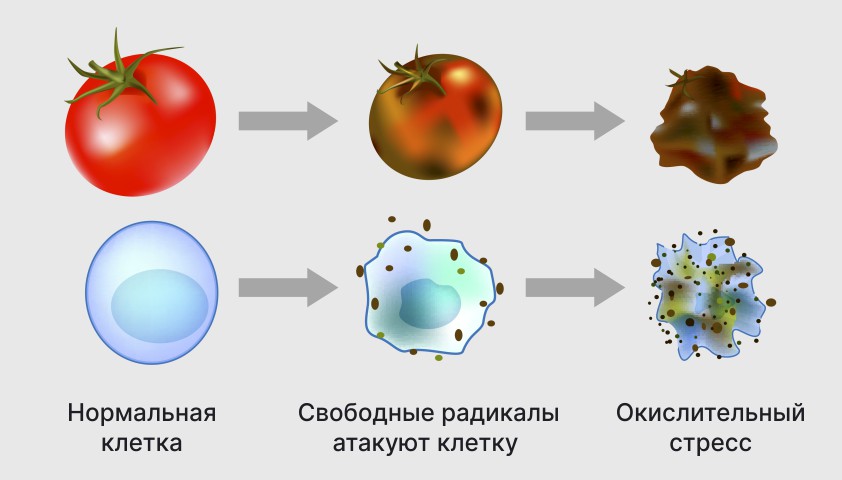
Свободные радикалы обладают высокой химической активностью и стремятся к стабильности. Они могут взаимодействовать с другими атомами и молекулами, отнимая у них электроны. Это может приводить к разрушению клеток и повреждению генетического кода в молекулах РНК и ДНК. Взаимодействие свободных радикалов со стабильными молекулами называется окислительным стрессом и считается причиной многих заболеваний, включая сердечно-сосудистые заболевания.
Свободные радикалы также могут быть связаны со старением организма, поскольку накопление радикалов и поврежденных клеток может привести к различным патологиям и раннему старению.
См. также
Стабильные радикалы
В органической химии существуют стабильные радикалы, которые имеют особую электронную конфигурацию и отличаются отобычных свободных радикалов. Они могут быть σ-электронными или π-электронными.
У σ-электронных радикалов неспаренный электрон находится на σ-орбитали, и радикал имеет практически то же строение, что и исходная молекула. Примерами таких радикалов являются фенильный, винильный и формильный радикалы.
У π-электронных радикалов неспаренный электрон находится на p-орбитали, и радикал имеет sp2-гибридизацию. Примерами таких радикалов являются алкильные, аллильные и бензильные радикалы.
Стабильность радикалов зависит от их энергетических свойств. Термодинамическая стабильность связана с эффективностью делокализации неспаренного электрона, а кинетическая стабильность определяется скоростью реакций радикалов с другими молекулами.

Выводы
Свободные радикалы в химии представляют собой частицы с неспаренными электронами на внешней электронной оболочке. Они обладают высокой химической активностью и могут повреждать клетки и генетический код. Окислительный стресс, вызванный взаимодействием свободных радикалов со стабильными молекулами, считается причиной многих заболеваний. Стабильные радикалы имеют особую электронную конфигурацию и отличаются отобычных радикалов. Изучение свободных и стабильных радикалов важно для понимания химических процессов в организмах и разработки методов их контроля и предотвращения.
Что нам скажет Википедия?
Свободные радикалы в химии — частицы, содержащие один или несколько неспаренных электронов на внешней электронной оболочке. Свободные радикалы бывают твёрдыми, жидкими и газообразными веществами и могут существовать от очень короткого (доли секунды) до очень долгого времени (до нескольких лет). Радикалы могут быть не только нейтральными, но и ионными (ион-радикалы), а также иметь более одного неспаренного электрона (как, например, у бирадикалов). Свободные радикалы обладают парамагнитными свойствами и являются очень реакционноспособными частицами.
У σ-электронных радикалов неспаренный электрон расположен на σ-орбитали. Как следствие, атом с неспаренным электроном сохраняет свою гибридизацию, а радикал имеет практически то же строение, что и исходная молекула. К σ-электронным радикалам относятся фенильный (C6H5•), винильный (CH2=CH•) и формильный (HC•=O) радикалы, а также карбоксильный (CO2-•) и пиридильный (C5H5N+•) ион-радикалы. В таких радикалах неспаренный электрон слабо делокализуется. Например, в фенильном радикале спиновая плотность на радикальном центре составляет 0,9918, а существенное взаимодействие наблюдается лишь с орто-протонами.
У π-электронных радикалов неспаренный электрон расположен на p-орбитали, вследствие чего радикальный центр имеет sp2-гибридизацию. Окружающие атомы при этом расположены в узловой плоскости этой орбитали, а радикал имеет вид плоского треугольника или низкой пирамиды с очень малым энергетическим барьером инверсии. К π-электронным радикалам относятся, например, алкильные, аллильные и бензильные радикалы. Из них метильный радикал является плоским, а радикалы CF3• и C(CH3)3• представляют собой низкие пирамиды. Это подтверждается тем, что, например трифторметильный радикал имеет ненулевой дипольный момент (0,43 Д).
Стабильность радикалов рассматривают с термодинамических и кинетических позиций, хотя в большинстве случаев оба вида факторов действуют одновременно. Термодинамическая стабильность радикалов связана с тем, насколько эффективно делокализован неспаренный электрон, поскольку делокализация снижает энтальпию образования свободного радикала. Оценить энтальпию образования радикала можно по энергии диссоциации связи, разрыв которой приводит к образованию этого радикала.
Короткоживущие свободные радикалы относятся к тем, у которых неспаренный электрон является локализованным, то есть у которых отсутствуют механизмы стабилизации за счёт участия соседних орбиталей или экранирования объёмными заместителями. Короткоживущими являются, например, радикалы NH2·, CH3·, OH·, SiH3· и др. Такие радикалы приходится стабилизировать либо при помощи сильного охлаждения (жидкими гелием, водородом, азотом или аргоном), либо за счёт эффекта клетки, когда свободные радикалы при низкой температуре находятся в окружении молекул застеклованного растворителя.
Долгоживущие свободные радикалы отличаются от короткоживущих тем, что неспаренный электрон в них сильно делокализован, а реакционный центр окружён объёмными заместителями, которые создают пространственные затруднения и понижают реакционную способность этого центра. Получают их различными химическими реакциями, в том числе реакциями одноэлектронного переноса и реакциями без затрагивания радикального центра.
Поскольку у свободных радикалов есть неспаренный электрон, они проявляют характерные химические свойства. Так, они вступают в реакции с другими частицами, содержащими неспаренный электрон: со свободными радикалами (в том числе рекомбинируют сами с собой), металлами и молекулярным кислородом. Также свободные радикалы способны реагировать с соединениями, которые легко диссоциируют на атомы. Один радикал может оторвать атом водорода от другого радикала: при этом происходит диспропорционирование (образуется одно насыщенное и одно ненасыщенное соединение), а общее число радикалов в системе уменьшается. Выделяют также реакции с переносом радикального центра, в которых неспаренный электрон в результате отрыва водорода или присоединения радикала по двойной связи оказывается на другой частице.