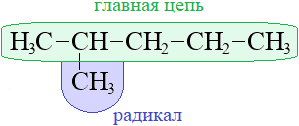
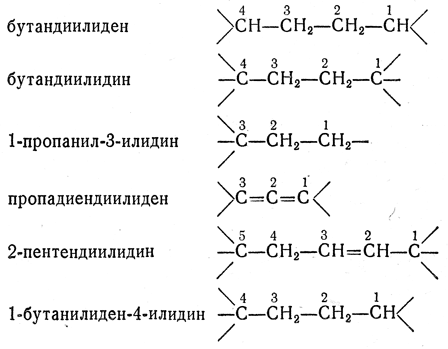Углеводородный радикал (от лат. radix "корень") - группа атомов, соединенная с функциональной группой молекулы. Узнайте, как образуется название углеводородного радикала и как они классифицируются в химии.
Углеводородный радикал (от лат. radix "корень"), также углеводородный остаток в химии - группа атомов, соединенная с функциональной группой молекулы. Обычно при химических реакциях радикал переходит из одного соединения в другое без изменения. Но радикал и сам может содержать функциональные группы, поэтому с его "неизменностью" нужно быть осторожным: например, аминокислота аспарагиновая кислота содержит в той части молекулы, которая в общем виде рассматривается как остаток аминокислоты, еще одну карбоксильную группу.
Моновалентные углеводородные радикалы
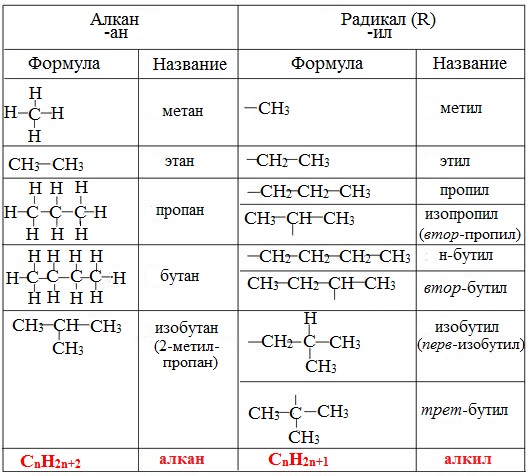
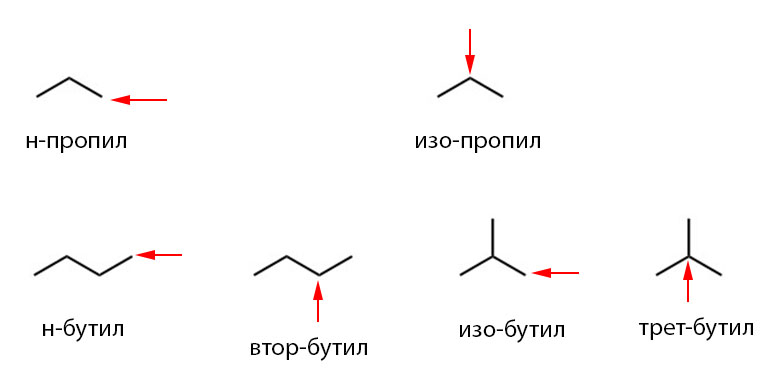
Название углеводородного радикала образуется от корня названия углеводорода путем прибавления к нему суффикса -ил. Суффиксы "-ен" и "-ин" сохраняются, чтобы не потерять представление о насыщенности углеводородного радикала. В более сложных углеводородных радикалах, например, полициклических, суффикс "-ан" сохраняется, вероятно, ввиду большей благозвучности. Перед суффиксом "-ил" указывается порядковый номер того атома углерода от начала цепи углеродных атомов радикала, у которого есть свободная валентность - кроме случая, если свободной валентностью обладает первый атом в цепи. Нумерация цепи идет от конца, ближайшего к свободной валентности. В случае, если в углеродной цепи с одной стороны атома со свободной(-ыми) валентностью(-ями) все атомы водорода замещены, то атом со свободными валентностями считается первым в цепи.
Примеры моновалентных углеводородных радикалов:
- Метиловый радикал (CH3)
- Этиловый радикал (C2H5)
- Пропиловый радикал (C3H7)
Поливалентные углеводородные радикалы
Если радикал способен присоединиться к атому углерода с образованием двойной или тройной связи или присоединиться сразу к нескольким атомам углерода (т.е., имеет несколько свободных валентностей), он называется поливалентным (в конкретном случае - би-, три-, и т.д. -валентным). Названия таких радикалов строятся путем присоединения к корню названия углеводорода суффикса "-илиден" или "-илидин" соответственно.
Примеры поливалентных углеводородных радикалов:
- Этиленовый радикал (C2H4)
- Пропиленовый радикал (C3H5)
- Бутиловый радикал (C4H9)
Часто углеводородный радикал называют просто радикал, что может вызвать путаницу с понятием свободного радикала. Некоторые углеводородные радикалы могут также являться функциональными группами, например, фенил (−C6H5), винил (−C2H3) и другие. Углеводородными радикалами обычно являются остатки углеводородов, которые входят в состав многих органических соединений.

Что нам скажет Википедия?
Углеводоро́дный радика́л (от лат. radix «корень»), также углеводоро́дный оста́ток в химии — группа атомов, соединённая с функциональной группой молекулы. Обычно при химических реакциях радикал переходит из одного соединения в другое без изменения. Но радикал и сам может содержать функциональные группы, поэтому с его «неизменностью» нужно быть осторожным: например, аминокислота аспарагиновая кислота содержит в той части молекулы, которая в общем виде рассматривается как остаток аминокислоты, ещё одну карбоксильную группу.
Часто углеводородный радикал называют просто радикал, что может вызвать путаницу с понятием свободного радикала. Некоторые углеводородные радикалы могут также являться функциональными группами, например, фенил (−C6H5), винил (−C2H3) и др. Углеводородными радикалами обычно являются остатки углеводородов, которые входят в состав многих органических соединений.
Название углеводородного радикала образуется от корня названия углеводорода путём прибавления к нему суффикса -ил. Суффиксы «-ен» и «-ин» сохраняются, чтобы не потерять представление о насыщенности углеводородного радикала. В более сложных углеводородных радикалах, например, полициклических, суффикс «-ан» сохраняется[1], вероятно, ввиду большей благозвучности. Перед суффиксом «-ил» указывается порядковый номер того атома углерода от начала цепи углеродных атомов радикала, у которого есть свободная валентность — кроме случая, если свободной валентностью обладает первый атом в цепи. Нумерация цепи идёт от конца, ближайшего к свободной валентности. В случае, если в углеродной цепи с одной стороны атома со свободной(-ыми) валентностью(-ями) все атомы водорода замещены, то атом со свободными валентностями считается первым в цепи. Ранее использовался и в тривиальных названиях используется характер атома со свободной валентностью — первичный, вторичный (сек- или втор-), третичный (терц- или трет-) (см. далее). В тривиальных наименованиях используются также корни исторически сложившихся названий веществ или связанных с ними понятий.
Если радикал способен присоединиться к атому углерода с образованием двойной или тройной связи или присоединиться сразу к нескольким атомам углерода (т. е., имеет несколько свободных валентностей), он называется поливалентным (в конкретном случае — би-, тривалентным, и т. д.). Названия таких радикалов строятся путём присоединения к корню названия углеводорода суффикса «-илиден» или «-илидин» соответственно. Ранее исключениями из этого правила были метилен и метин (но не теперь); впрочем, применяются и эти названия.
Поливалентные углеводородные радикалы также могут быть поименованы согласно l-соглашению. В этом случае название строится по схеме: [заместитель при атоме со свободной валентностью] — [порядковый номер атома со свободной валентностью] ln — [название углеводорода, который получился бы при образовании на месте свободных валентностей связей с атомами водорода]. n здесь — количество свободных валентностей, которыми обладает атом.
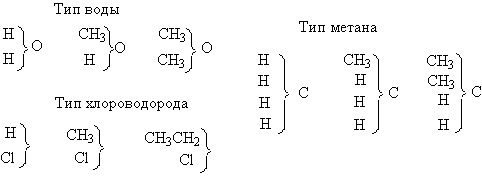
Тривиальные, не номенклатурные названия многих органических соединений состоят из названия углеводородного радикала и названия атомов или групп атомов, замещающих водород, например: СН3Сl — хлористый метил, C2H5Br — бромистый этил и т. д.
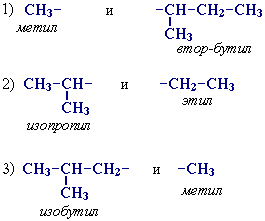
Тривиальные названия радикалов, как уже сказано выше, часто основаны на характере атомов углерода в радикале. Характер атома определяется так: первичный атом связан с одним атомом углерода, вторичный — с двумя и т. д. При названии радикалов используются латинские (sec-, tert-) или русские (втор-, трет-) приставки. Первичные атомы никак не обозначаются. Если на самом конце радикала есть третичный атом, добавляют приставку изо-. Радикалы с четвертичными атомами имеют приставку нео-.