Кислоты - это химические соединения, которые обладают способностью отдавать катион водорода или принимать электронную пару с образованием ковалентной связи. Они являются важными соединениями в химии и имеют множество свойств и применений. В этой статье вы найдете информацию о кислотах, их определении, истории и классификации. Узнайте больше о кислотах на сайте Мария-Косметолог.
Cодержание
Кислоты - это химические соединения, которые обладают способностью отдавать катион водорода или принимать электронную пару с образованием ковалентной связи. Они являются важными соединениями в химии и имеют множество свойств и применений.
Определение кислоты
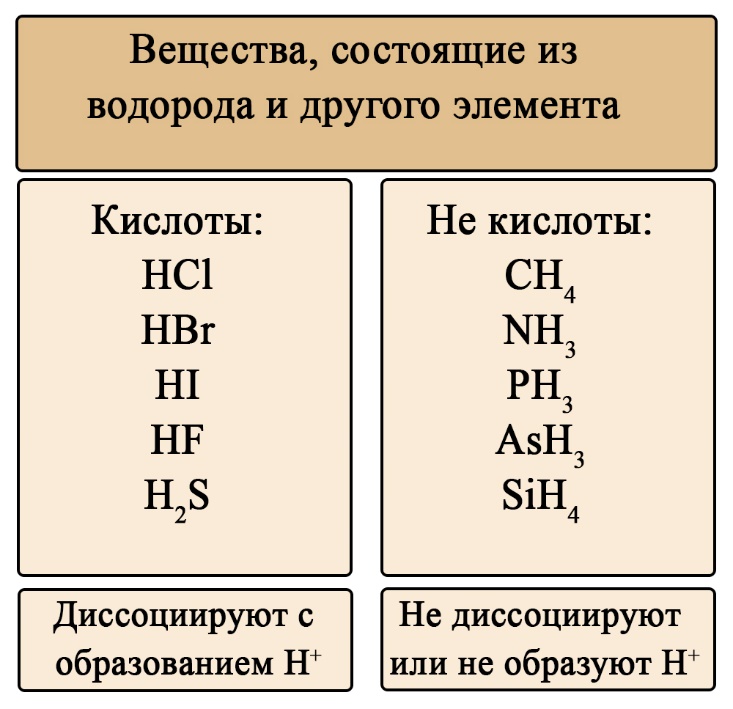
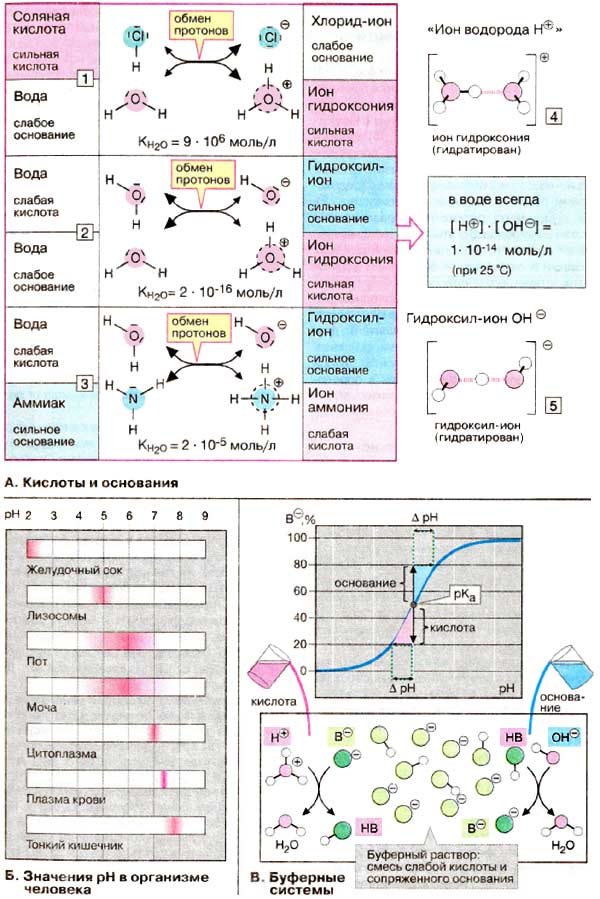
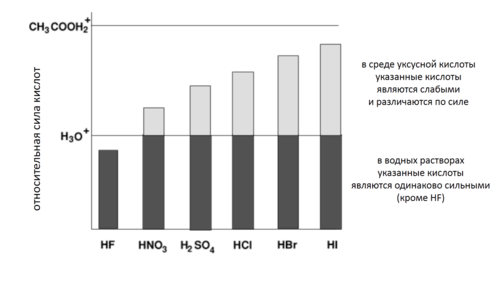
В быту и технике, под кислотами обычно подразумеваются кислоты Брёнстеда. Эти кислоты образуют в водных растворах избыток ионов гидроксония H3O+, что обуславливает их кислый вкус, способность менять окраску индикаторов и вызывать раздражающее действие при высоких концентрациях. Атомы водорода в кислотах могут замещаться на атомы металлов с образованием солей, содержащих катионы металлов и анионы кислотного остатка.

История развития представлений о кислотах
Кислоты как класс химических соединений известны с древнейших времен. Французский химик Антуан Лавуазье в 1778 году предположил, что кислотные свойства обусловлены наличием кислорода в их составе. Однако эта гипотеза оказалась несостоятельной, так как не все кислоты содержат кислород, а некоторые кислородсодержащие соединения не обладают кислотными свойствами.
В 1833 году немецкий химик Юстус Либих определил кислоту как водородсодержащее соединение, в котором водород может быть замещён на металл. Первую общую теорию кислот и оснований предложил шведский физикохимик Сванте Аррениус в 1887 году, определив кислоту как соединение, диссоциирующее в водном растворе с образованием ионов водорода H+.
Сольвентная теория Франклина, разработанная в 1924 году, определяет кислоту как вещество, которое при растворении увеличивает число катионов, образующихся при диссоциации растворителя. Эта теория имеет важное значение при исследовании неводных растворов кислот.
См. также
Классификация кислот
Кислоты могут быть классифицированы на неорганические и органические.
Неорганические кислоты
Неорганические кислоты содержат протон H+ в своем составе, что определяет их кислотные свойства.
Органические кислоты
Органические кислоты имеют карбоксильную группу -COOH и проявляют более слабые кислотные свойства по сравнению с неорганическими кислотами. Они классифицируются на одноосновные и многоосновные в зависимости от числа карбоксильных групп в их составе.
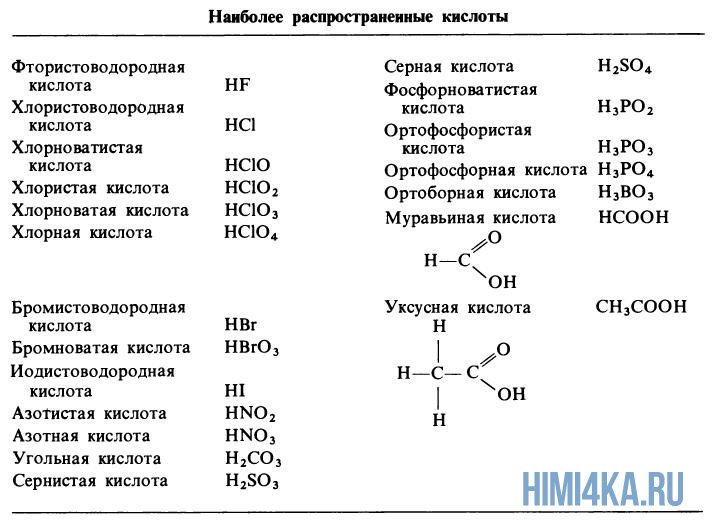
Примеры кислот
Органические кислоты являются широко распространенными в природе. Некоторые из самых известных органических кислот включают уксусную, лимонную, молочную, муравьиную, бензойную, щавелевую и яблочную кислоты.
Неорганические кислоты также имеют свои примеры, такие как серная кислота.

Что нам скажет Википедия?
Органические кислоты – органические вещества, проявляющие кислотные свойства. К ним относятся карбоновые кислоты, содержащие карбоксильную группу -COOH, сульфоновые кислоты, содержащие сульфогруппу -SO3H и некоторые другие.
Самыми известными органическими кислотами являются уксусная, лимонная, молочная, муравьиная, бензойная, щавелевая и яблочная.
В растительных продуктах чаще всего встречаются органические кислоты – яблочная, лимонная, винная, щавелевая, пировиноградная, молочная. В животных продуктах распространены молочная, фосфорная и другие кислоты. Кроме того, в свободном состоянии в небольших количествах в продуктах находятся жирные кислоты, которые иногда ухудшают их вкус и запах. Благодаря наличию свободных кислот и кислых солей многие продукты и их водные вытяжки обладают кислой реакцией.
Классификация
- Неорганические кислоты содержат в своем составе протон Н+, который и определяет их кислотные свойства.
- Органические устроены по-другому, в их составе находится карбоксильная группа -СООН. В органической химии их называют карбоновыми кислотами с общей формулой R-COOH, где R – это углеводородный радикал (лат. «carbo» – уголь и греч. «oxys» – кислый). По сравнению со своими неорганическими «собратьями» они проявляют более слабые кислотные свойства. Различаются органические кислоты по числу карбоксильных групп. Они бывают одноосновными и многоосновными.