Узнайте, что означает, когда значение pH больше 7 и как это связано с щелочными растворами. Водородный показатель (pH) является мерой кислотности водных растворов. Он выражает активность катионов водорода (H+) в растворах и противоположен по знаку и равен по модулю десятичному логарифму активности этих катионов. Узнайте о значении pH в различных растворах и его важности для организма. Читайте статью на Мария-Косметолог.
Cодержание
Водородный показатель (pH) является мерой кислотности водных растворов. Он выражает активность катионов водорода (H+) в растворах и противоположен по знаку и равен по модулю десятичному логарифму активности этих катионов. Точное измерение и регулирование pH является необходимым в различных науках и отраслях, таких как химия, биология, науки о материалах, технологии, медицина и агрономическая химия.

История
Понятие pH было введено датским химиком Сёренсеном в 1909 году. Показатель называется pH, по первым буквам латинских слов "potentia hydrogenii" (сила водорода) или "pondus hydrogenii" (вес водорода). В химии обычно обозначается как pX, где X - химическое вещество. Для pH буква H обозначает концентрацию ионов водорода (H+), или гидроксоний-ионов.

Уравнения, связывающие pH и pOH
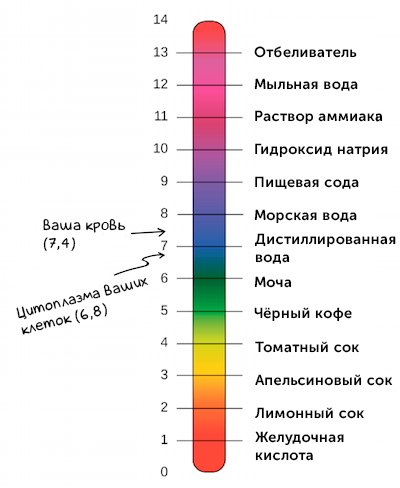
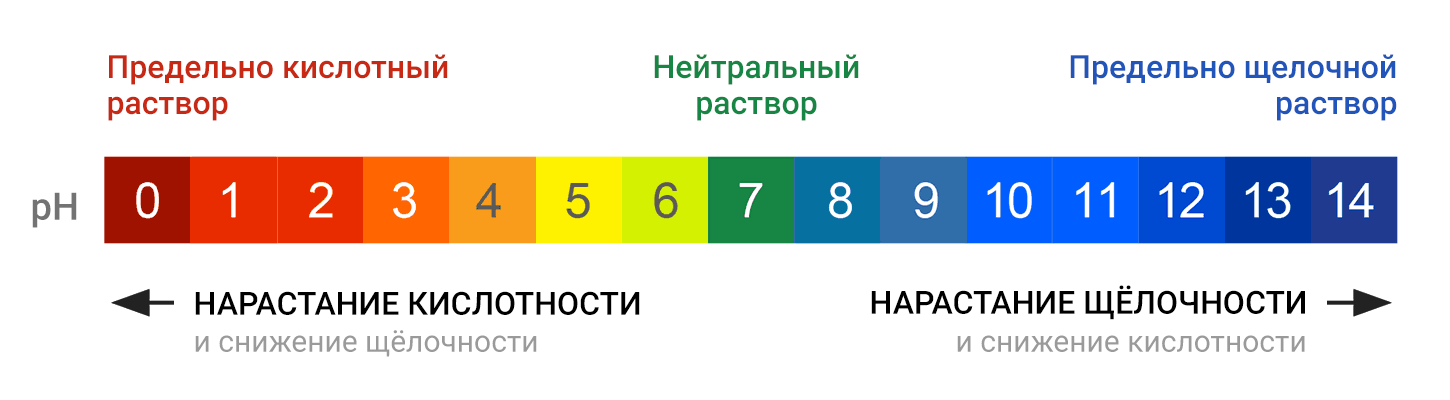
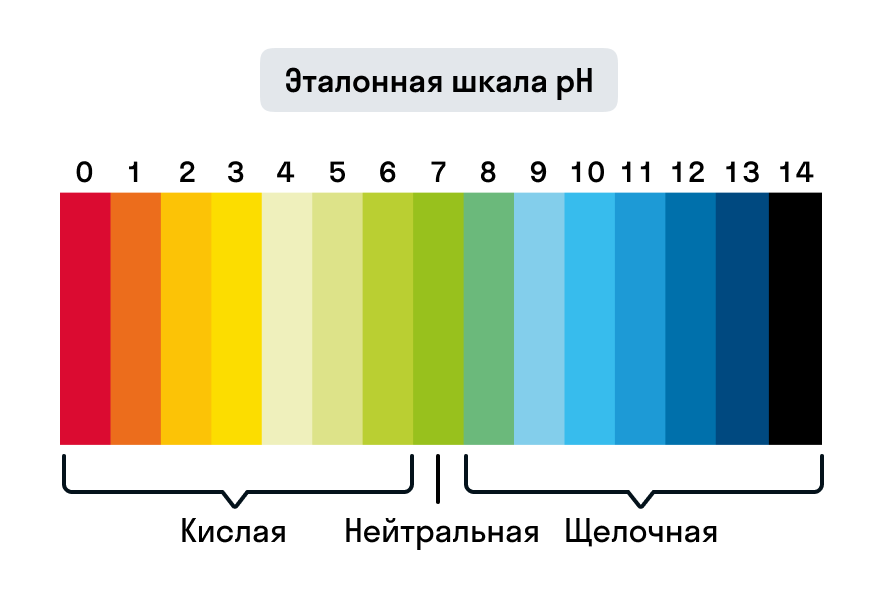
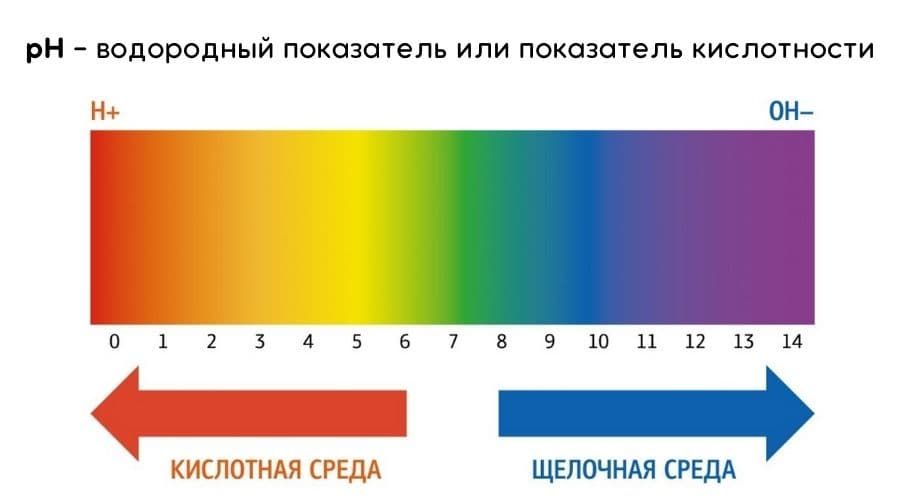
Водородный показатель pH связан с показателем основности раствора, pOH. При 25 °C справедливо равенство pH + pOH = 14. В кислотных растворах pH меньше 7, в основных растворах pH больше 7, а для нейтральных растворов pH равен 7.
См. также
Значение pH больше 7
Когда значение pH больше 7, это указывает на щелочную реакцию водного раствора. В щелочных растворах концентрация гидроксид-ионов (OH-) преобладает над концентрацией ионов водорода. Щелочные растворы имеют свойства нейтрализовать кислоты и обладают повышенной щелочностью.
Классификация воды по уровню pH
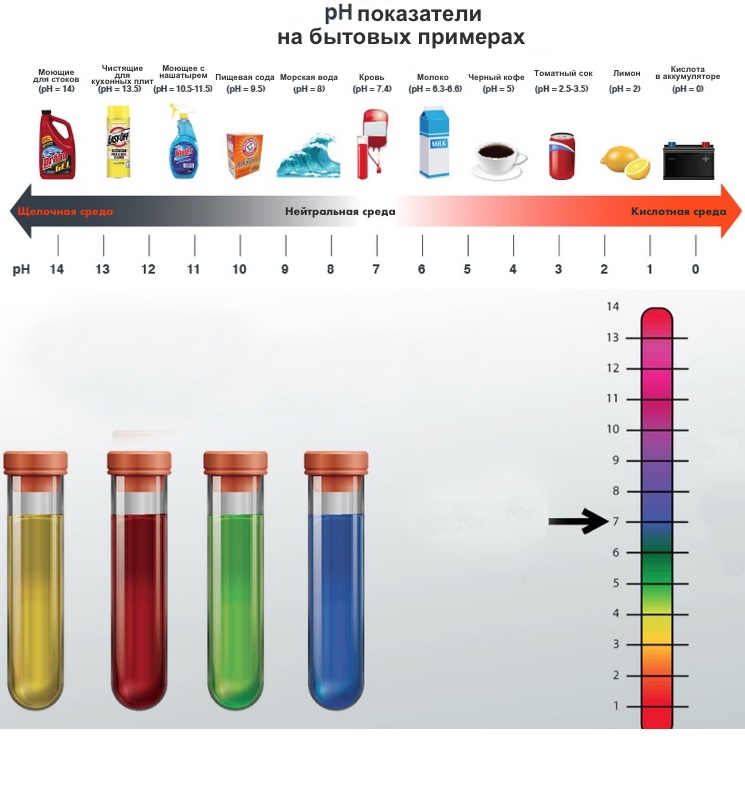
В зависимости от значения pH, вода может быть классифицирована на кислую, нейтральную или щелочную. Если pH воды меньше 7, то она считается кислой. Если pH равно 7, то вода считается нейтральной. А если pH больше 7, то вода считается щелочной. Как уже упоминалось, щелочные растворы обладают повышенной щелочностью.

Уровень pH воды
Показатель pH воды имеет важное значение для определения кислотно-щелочного баланса. От него зависит коррозионная агрессивность жидкости, скорость химических реакций и степень токсичности загрязняющих веществ. Нормальный уровень pH питьевой воды составляет примерно 7-7.5. Этот уровень обеспечивает благоприятное воздействие на организм человека.
Важность кислотно-щелочного баланса заключается в том, что он определенным образом влияет на состояние человеческого организма. Например, употребление кислых газированных напитков может снизить уровень pH крови, что может привести к неприятным ощущениям во рту. Поэтому рекомендуется пить воду с нормальным уровнем pH для поддержания здоровья и благополучия.
См. также
Что нам скажет Википедия?
Водоро́дный показа́тель (pH [пэ-аш] ← лат. pondus Hydrogenii «вес водорода») — мера кислотности водных растворов. Является способом выражения активности катионов водорода в растворах. Противоположна по знаку и равна по модулю десятичному логарифму активности (а) катионов водорода (Н+), выраженной в молях на литр, которую в сильно разбавленных растворах можно считать равной их равновесной молярной концентрации ([H+]):
Для водных растворов (при стандартных условиях):
Водородный показатель может быть определён с помощью кислотно-основных индикаторов, измерен потенциометрическим pH-метром.
Точное измерение и регулирование pH необходимо в различных отраслях химии, биологии, наук о материалах, технологий, медицины и агрономической химии[⇨].
Уравнения, связывающие pH и pOH
Вывод значения pH
Для удобства представления, чтобы избавиться от отрицательного показателя степени, вместо концентрации ионов водорода используют её взятый с обратным знаком десятичный логарифм, который, собственно, и является водородным показателем — pH.
Несколько меньшее распространение получила обратная pH величина — показатель осно́вности раствора, pOH, равная отрицательному десятичному логарифму концентрации в растворе ионов OH−:
Так как при 25 °C [H+] · [OH−] = 10−14, то понятно, что при этой температуре pH + pOH = 14.
Так как в кислотных растворах [H+] > 10−7, то у кислотных растворов pH < 7, аналогично, у осно́вных растворов pH > 7, pH нейтральных растворов равен 7. При более высоких температурах константа электролитической диссоциации воды повышается, соответственно увеличивается ионное произведение воды, поэтому нейтральной оказывается pH < 7 (что соответствует одновременно возросшим концентрациям как H+, так и OH−); при понижении температуры, напротив, нейтральная pH возрастает.
Кислотность среды имеет важное значение для множества химических процессов, и возможность протекания или результат той или иной реакции часто зависит от pH среды. Для поддержания определённого значения pH в реакционной системе при проведении лабораторных исследований или на производстве применяют буферные растворы, которые позволяют сохранять практически постоянное значение pH при разбавлении или при добавлении в раствор небольших количеств кислоты или щёлочи.
Водородный показатель pH широко используется для характеристики кислотно-осно́вных свойств различных биологических сред.
Кислотность реакционной среды особое значение имеет для биохимических реакций, протекающих в живых системах. Концентрация в растворе ионов водорода часто оказывает влияние на физико-химические свойства и биологическую активность белков и нуклеиновых кислот, поэтому для нормального функционирования организма поддержание кислотно-осно́вного гомеостаза является задачей исключительной важности. Динамическое поддержание оптимального pH биологических жидкостей достигается благодаря действию буферных систем организма.
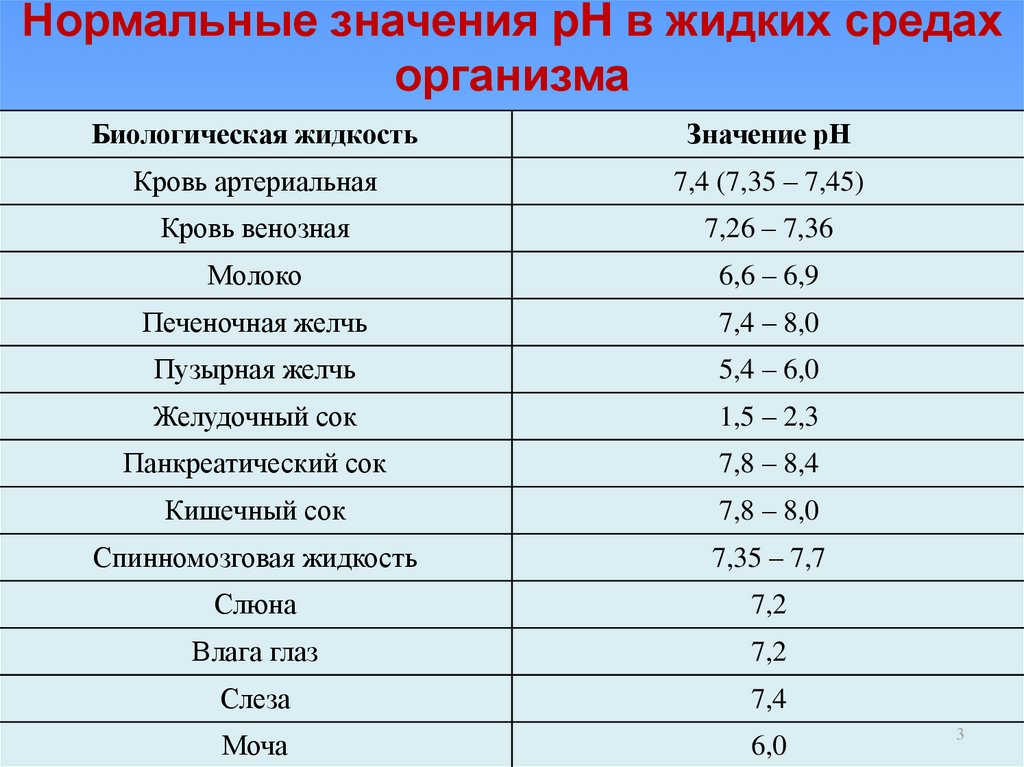
В человеческом организме в различных органах водородный показатель различен. Нормальный pH крови составляет 7,36, то есть кровь имеет слабоосновную реакцию (с колебаниями от 7,34 у венозной крови до 7,40 у артериальной). В зависимости от биохимических изменений в крови может наблюдаться ацидоз (увеличение кислотности) или алкалоз (увеличение осно́вности), однако совместимый с жизнью диапазон pH крови невелик, поскольку уже при уменьшении pH до 6,95 наступает потеря сознания, а смещение реакции крови в щелочную сторону до pH = 7,7 вызывает тяжелейшие судороги. Поддержание кислотно-основного баланса крови в допустимых пределах осуществляется буферными системами крови, главной из которых является гемоглобиновая. Нормальный водородный показатель желудочного сока (в просвете тела желудка натощак) равен 1,5…2,0. У сока тонкой кишки pH в норме составляет 7,2…7,5, при усилении секреции достигает 8,6. pH содержимого толстого кишечника может варьировать в норме от 6,0 до 7,2 единиц и зависит прежде всего от уровня продукции жирных кислот его микробиотой.