В данной статье вы узнаете, что такое свободные радикалы в химии и какие частицы считаются ими. Познакомьтесь с историей открытия радикалов и различными типами радикалов. Узнайте о парамагнитных свойствах и реакционной активности свободных радикалов. Подробности на сайте Мария-Косметолог.
Cодержание
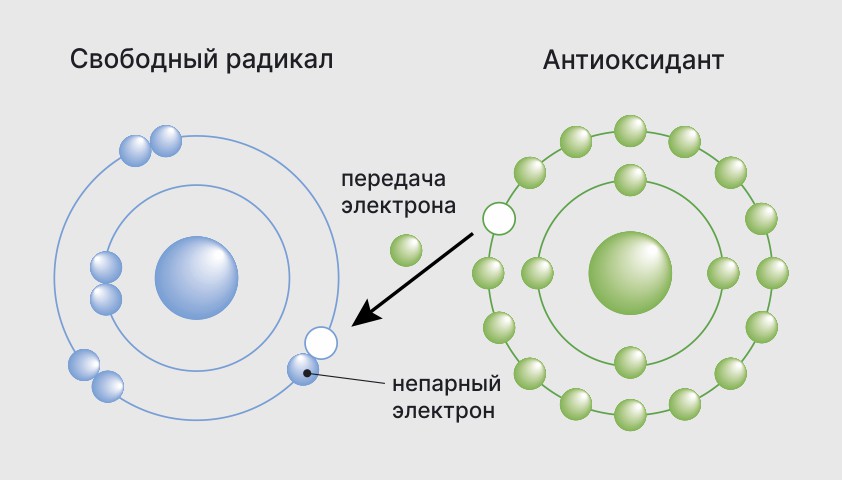
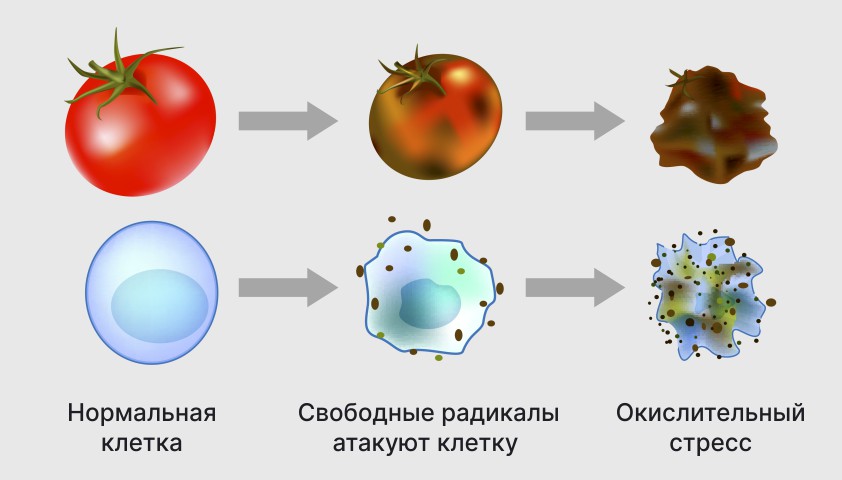
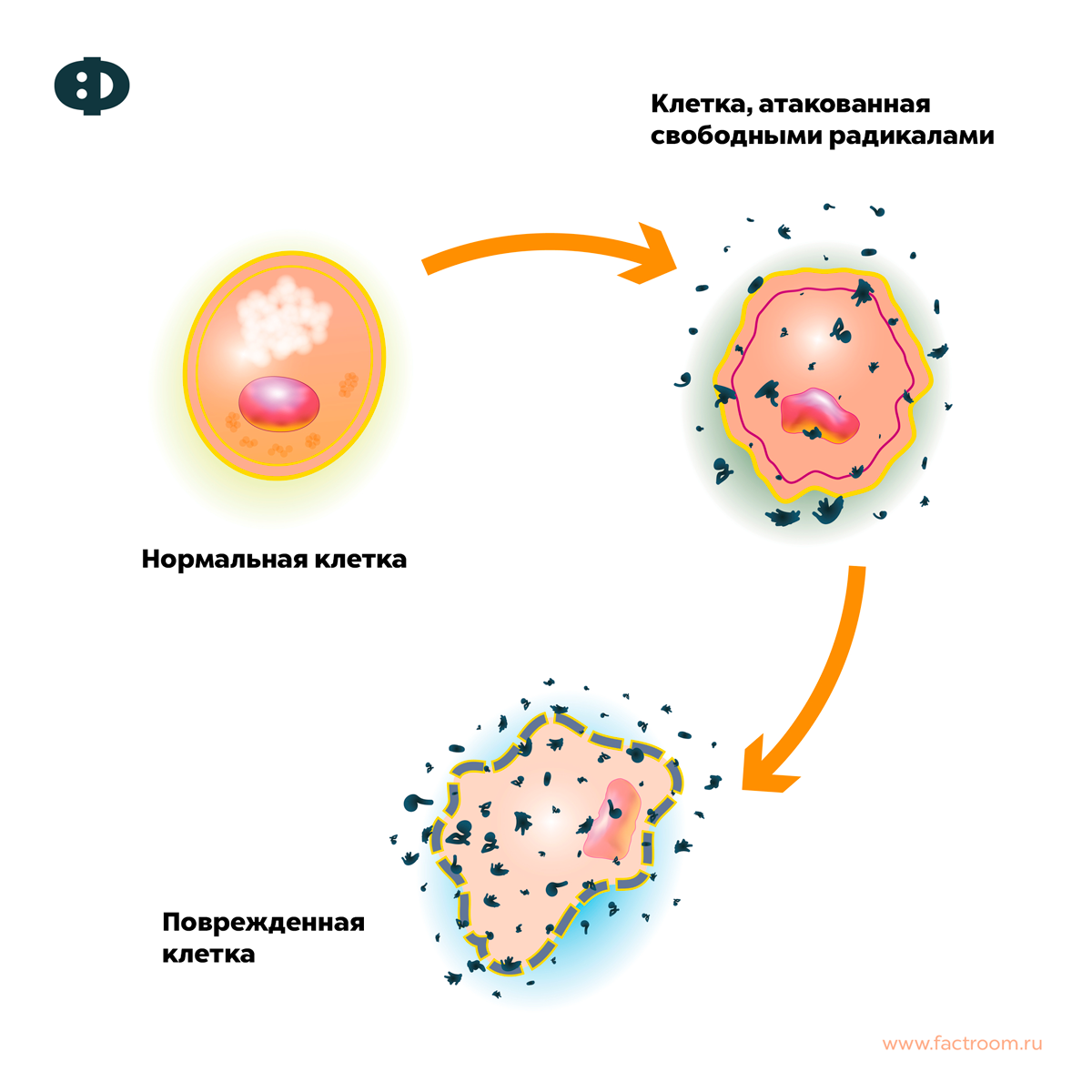
Свободные радикалы в химии — частицы, содержащие один или несколько неспаренных электронов на внешней электронной оболочке. Свободные радикалы бывают твёрдыми, жидкими и газообразными веществами и могут существовать от очень короткого (доли секунды) до очень долгого времени (до нескольких лет). Радикалы могут быть не только нейтральными, но и ионными (ион-радикалы), а также иметь более одного неспаренного электрона (как, например, у бирадикалов). Свободные радикалы обладают парамагнитными свойствами и являются очень реакционноспособными частицами.
История открытия
Существование свободных радикалов постулировалось ещё в XIX веке. В 1849 году английский химик Эдуард Франкленд нагреванием иодэтана с цинком получил бутан, полагая, что это этильный радикал. Подобную ошибку допустил и немецкий химик Герман Кольбе, приняв этан за метильный радикал.
Впервые свободный радикал в растворе обнаружил американский химик Мозес Гомберг. В 1900 году он открыл трифенилметильный радикал, получив его действием серебра на трифенилметилхлорид. Из-за присутствия этого радикала раствор был окрашен в жёлтый цвет, а затем из раствора выпали белые кристаллы димера этого радикала.
В 1929 году немецкий химик Фридрих Панет идентифицировал метильный и этильный радикалы. В одном из экспериментов он разлагал тетраметилсвинец в токе водорода в термостойкой стеклянной трубке. При этом образовывались метильные радикалы, которые увлекались током водорода дальше по трубке, и металлический свинец, который выпадал на внутреннем диаметре в виде зеркала. Через 30 см от места разложения тетраметилсвинца внутри трубки находилось другое, заранее нанесённое свинцовое зеркало. Пролетающие метильные радикалы реагировали с этим свинцом, снова образуя тетраметилсвинец, который конденсировался в конце установки. Этот же эксперимент позволил благодаря варьированию расстояния между местом разложения и свинцовым зеркалом, а также по скорости тока водорода оценить время жизни радикалов. В условиях опыта (при 1—2 мм рт. ст.) оно составило около 0,0084 секунд.
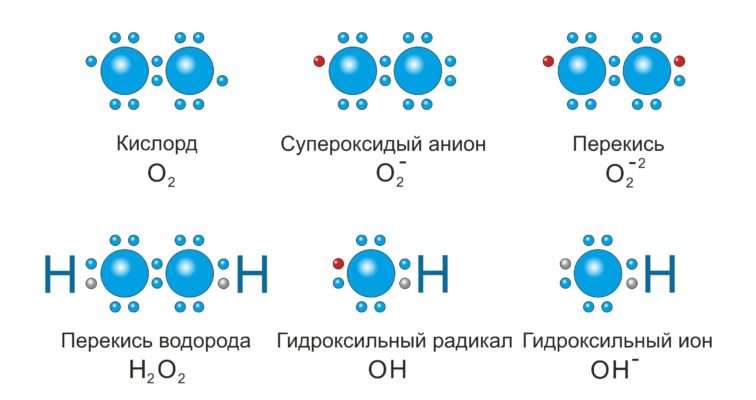
В 1930 году Г. А. Разуваев и В. Н. Ипатьев изучали фотолиз диметилртути в четырёххлористом углероде и установили, что в ходе процесса образуются такие продукты, которые могут образоваться только в ходе гомолитического распада связи ртуть — углерод. Это радикалы свободные (радикалы), частицы (атомы, молекулы, фрагменты молекул), содержащие один или несколько неспаренных электронов на внешних атомных или молекулярных орбиталях. Примеры неорганических и органических радикалов – гидроксил HO• и этоксил C2H5O• (неспаренный электрон обозначают точкой). Частицы с двумя неспаренными электронами на атомных орбиталях разных атомов называют бирадикалами; например, (C6H5)2C•C6H4–C6H4C•(C6H5)2. Радикалы свободные электронейтральны. Отдача или прием электрона нейтральной частицей, не имеющей неспаренных электронов, приводит к образованию ион-радикалов (катион-радикалов или анион-радикалов) – частиц, обладающих одновременно зарядом и неспаренным электроном; примеры – катион-радикал бензола C6H6•+, анион-радикал бензофенона (C6H5)2C•–O−.

Термин "радикал" и его эволюция
Термин "радикал", одно из наиболее эволюционировавших понятий в химии, предложил в 1782 г. Л. Б. Гитон де Морво. В рамках кислородной теории А. Лавуазье радикалом (от лат. radix, род. п. radicis – корень, основание) называли "кинетические начала" кислот (по Лавуазье, кислоты – соединения кислорода с радикалами). Постепенно понятие "радикал" уходило из неорганической химии и перемещалось преимущественно в органическую химию. Лавуазье предложил словосочетание "свободный радикал" для обозначения углеводородов вследствие их способности соединяться с кислородом. Ю. Либих и Ф. Вёлер обнаружили (1832), что группа C6H5CO (названная ими бензоилом) в реакциях "горькоминдального масла" (бензальдегида) остаётся неизменной и легко обнаруживается в бензойной кислоте, бензальдегиде, бензоилхлориде, бензамиде. Постепенно выявлялись ряды органических соединений, в которых неизменной составляющей был органический радикал (например, этил C2H5 – в этиловом спирте, этилхлориде, диэтиловом эфире и др.). Под радикалом стали понимать группировки, входящие в состав органических молекул в неизменённом виде (следует иметь в виду, что до настоящего времени название "радикал" используется в номенклатуре органических соединений для обозначения заместителей – углеводородных остатков, составляющих молекулу; например, боковая цепь в 3-метилпентане – метильный радикал).
См. также
Различные типы свободных радикалов
Свободные радикалы делят на σ-электронные и π-электронные. У σ-электронных радикалов неспаренный электрон расположен на σ-орбитали. Как следствие, атом с неспаренным электроном сохраняет свою гибридизацию, а радикал имеет практически то же строение, что и исходная молекула. К σ-электронным радикалам относятся фенильный (C6H5•), винильный (CH2=CH•) и формильный (HC•=O) радикалы, а также карбоксильный (CO2-•) и пиридильный (C5H5N+•) ион-радикалы. В таких радикалах неспаренный электрон слабо делокализуется. Например, в фенильном радикале спиновая плотность на радикальном центре составляет 0,9918, а существенное взаимодействие наблюдается лишь с орто-протонами.
У π-электронных радикалов неспаренный электрон расположен на p-орбитали, вследствие чего радикальный центр имеет sp2-гибридизацию. Окружающие атомы при этом расположены в узловой плоскости этой орбитали, а радикал имеет вид плоского треугольника или низкой пирамиды с очень малым энергетическим барьером инверсии. К π-электронным радикалам относятся, например, алкильные, аллильные и бензильные радикалы. Из них метильный радикал является плоским, а радикалы CF3• и C(CH3)3• представляют собой низкие пирамиды. Это подтверждается тем, что, например, трифторметильный радикал имеет ненулевой дипольный момент (0,43 Д).
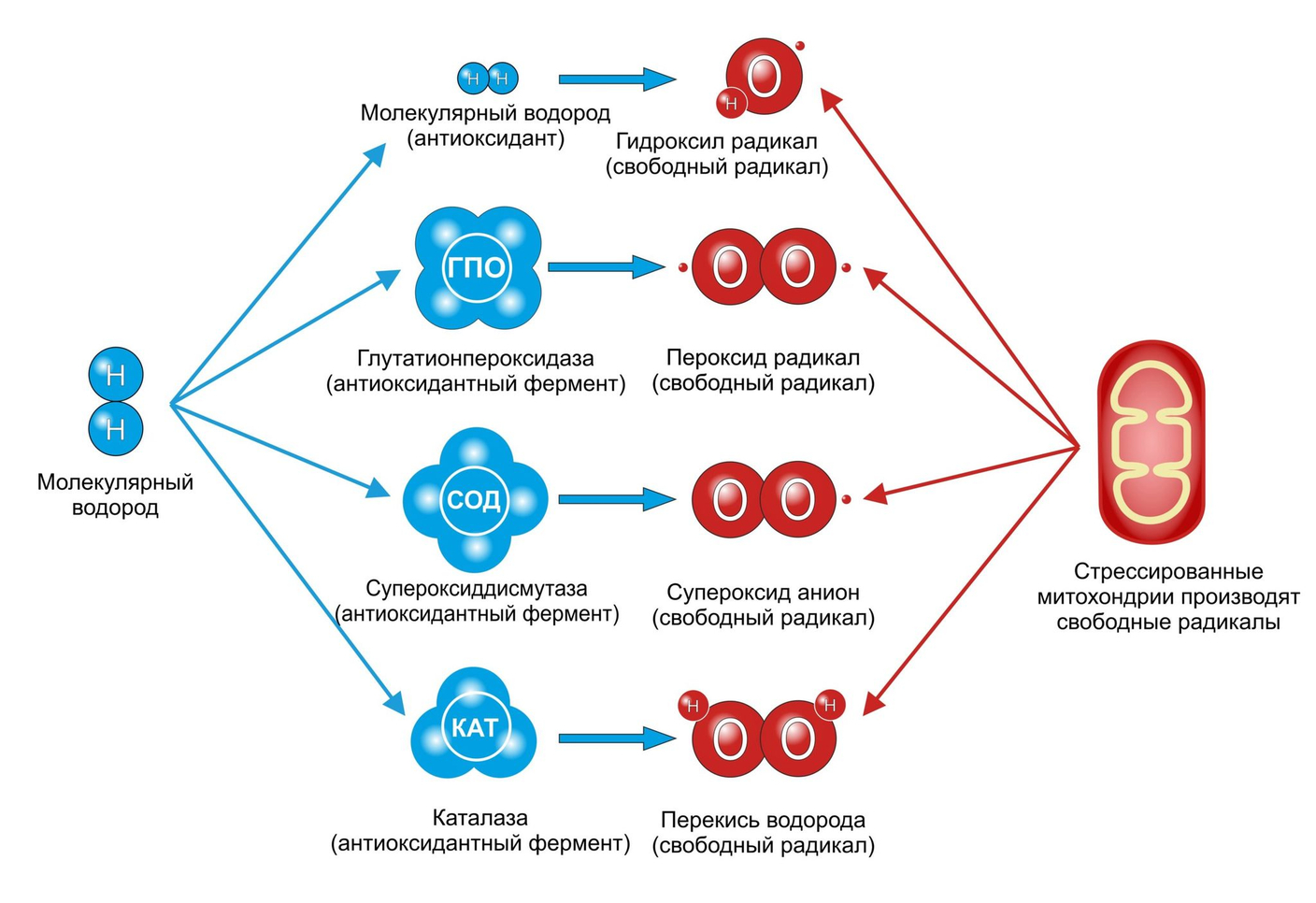
Химические свойства свободных радикалов
Каждый радикал может проявлять характерные химические свойства, вступая в реакции с другими частицами, содержащими неспаренный электрон или подвергаясь реакциям с переносом радикального центра. Свободные радикалы обладают парамагнитными свойствами и являются очень реакционноспособными частицами.

Что нам скажет Википедия?
Свободные радикалы в химии — частицы, содержащие один или несколько неспаренных электронов на внешней электронной оболочке. Свободные радикалы бывают твёрдыми, жидкими и газообразными веществами и могут существовать от очень короткого (доли секунды) до очень долгого времени (до нескольких лет). Радикалы могут быть не только нейтральными, но и ионными (ион-радикалы), а также иметь более одного неспаренного электрона (как, например, у бирадикалов). Свободные радикалы обладают парамагнитными свойствами и являются очень реакционноспособными частицами.
Свободные радикалы делят на σ-электронные и π-электронные. У σ-электронных радикалов неспаренный электрон расположен на σ-орбитали. Как следствие, атом с неспаренным электроном сохраняет свою гибридизацию, а радикал имеет практически то же строение, что и исходная молекула. К σ-электронным радикалам относятся фенильный (C6H5•), винильный (CH2=CH•) и формильный (HC•=O) радикалы, а также карбоксильный (CO2-•) и пиридильный (C5H5N+•) ион-радикалы. В таких радикалах неспаренный электрон слабо делокализуется. Например, в фенильном радикале спиновая плотность на радикальном центре составляет 0,9918, а существенное взаимодействие наблюдается лишь с орто-протонами.
У π-электронных радикалов неспаренный электрон расположен на p-орбитали, вследствие чего радикальный центр имеет sp2-гибридизацию. Окружающие атомы при этом расположены в узловой плоскости этой орбитали, а радикал имеет вид плоского треугольника или низкой пирамиды с очень малым энергетическим барьером инверсии. К π-электронным радикалам относятся, например, алкильные, аллильные и бензильные радикалы. Из них метильный радикал является плоским, а радикалы CF3• и C(CH3)3• представляют собой низкие пирамиды. Это подтверждается тем, что, например трифторметильный радикал имеет ненулевой дипольный момент (0,43 Д).
Каждый радикал может проявлять характерные химические свойства, вступая в реакции с другими частицами, содержащими неспаренный электрон или подвергаясь реакциям с переносом радикального центра. Свободные радикалы обладают парамагнитными свойствами и являются очень реакционноспособными частицами.