Узнайте, что такое водородный показатель (pH) и как он влияет на воду и организм человека. Разберитесь в классификации воды по уровню pH и узнайте нормальные значения pH питьевой воды. Определите методы измерения показателя pH и его важность в различных отраслях наук.
Cодержание
Введение
Водоро́дный показа́тель (pH) является мерой кислотности водных растворов и способом выражения активности катионов водорода в растворах. Он противоположен по знаку и равен по модулю десятичному логарифму активности (а) катионов водорода (Н+), выраженной в молях на литр, которую в сильно разбавленных растворах можно считать равной их равновесной молярной концентрации ([H+]).

История
Введение понятия pH произошло в 1909 году благодаря датскому химику Сёренсену. Показатель назван pH, по первым буквам латинских слов potentia hydrogenii - сила водорода, или pondus hydrogenii - вес водорода. В химии принято обозначать величину, равную -lg X, сочетанием пX. Например, силу кислот часто выражают в виде pKa = -lg Ka. В случае pH, буква H обозначает концентрацию ионов водорода (H+), или, точнее, термодинамическую активность гидроксоний-ионов.

Уравнения, связывающие pH и pOH
Для водных растворов при стандартных условиях, pH может быть определен с помощью кислотно-основных индикаторов или измерен потенциометрическим pH-метром.
См. также
Влияние pH на воду и организм
Уровень pH воды является важным параметром, определяющим кислотно-щелочной баланс жидкости. Он влияет на коррозионную агрессивность жидкости, скорость химических реакций и степень токсичности загрязняющих веществ. Кислотно-щелочной баланс питьевой воды оказывает определенное влияние на состояние человеческого организма.
Термин pH был введен в начале ХХ века датским химиком Сореном Петром Лаурицем Соренсеном. Ученый определил pH как единицу измерения активности ионов водорода, выражающую кислотность любого вещества. РН воды демонстрирует количественное соотношение в воде ионов Н+ и ОН-, возникающих при диссоциации воды.

Классификация воды по уровню pH
В зависимости от показателя pH, вода делится на несколько групп:
- Кислая вода - с показателем рН меньше 7;
- Нейтральная вода - с показателем рН равным 7;
- Щелочная вода - с показателем рН больше 7.
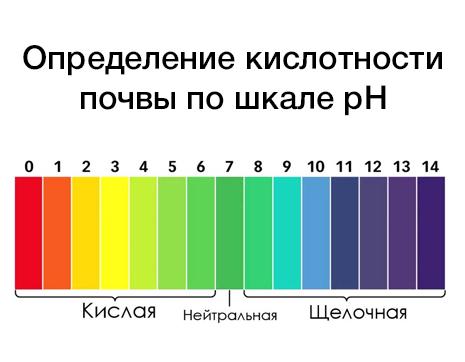
Норма pH воды
Нормальные показатели pH питьевой воды должны приближаться к показателю pH крови человека, который составляет примерно 7,5. Таким образом, нормальные значения pH питьевой воды находятся в диапазоне от 7 до 7,5 единиц.
Сбалансированный показатель pH питьевой воды имеет множественные благоприятные эффекты на организм:
- Поддерживает здоровье и хорошее самочувствие;
- Предотвращает обезвоживание;
- Улучшает работу пищеварительной системы;
- Способствует нормализации обмена веществ;
- Повышает иммунитет;
- Улучшает состояние кожи и волос.
См. также
Определение показателя pH воды
Существуют несколько методов для определения показателя pH конкретной среды:
- Использование индикаторной бумаги или раствора для определения кислотности;
- Использование инструментального метода с помощью pH-метра.
Инструментальный метод считается наиболее точным в определении показателя pH.

Вывод
Водородный показатель (pH) является важным параметром для определения кислотности водных растворов. Он имеет влияние на различные отрасли наук, такие как химия, биология, науки о материалах, технологии, медицина и агрономическая химия. Корректное измерение и регулирование pH необходимо для обеспечения качества и безопасности воды.

Что нам скажет Википедия?
Водоро́дный показа́тель (pH [пэ-аш] ← лат. pondus Hydrogenii «вес водорода») — мера кислотности водных растворов. Является способом выражения активности катионов водорода в растворах. Противоположна по знаку и равна по модулю десятичному логарифму активности (а) катионов водорода (Н+), выраженной в молях на литр, которую в сильно разбавленных растворах можно считать равной их равновесной молярной концентрации ([H+]):
Для водных растворов (при стандартных условиях):
- Водородный показатель может быть определён с помощью кислотно-основных индикаторов, измерен потенциометрическим pH-метром.
Точное измерение и регулирование pH необходимо в различных отраслях химии, биологии, наук о материалах, технологий, медицины и агрономической химии.