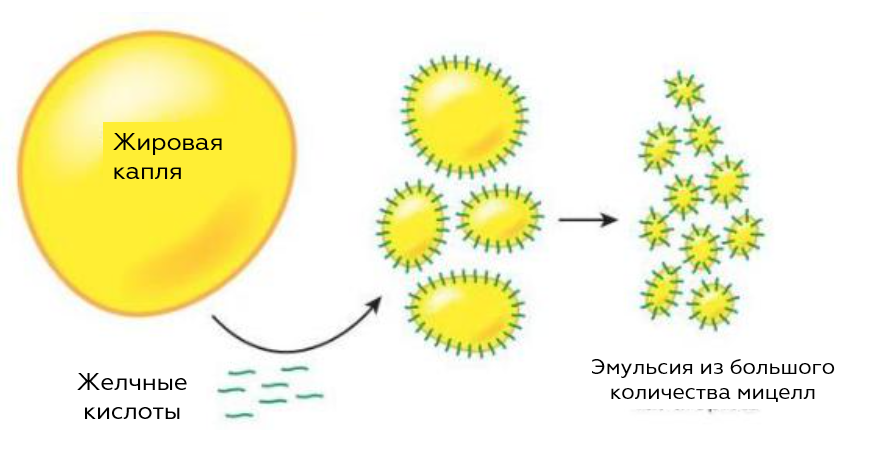
Мицелла это агрегаты поверхностно-активных веществ (ПАВ) в коллоидном растворе, состоящие из большого количества амфифильных молекул. Узнайте о свойствах, применении и переходе к мицеллообразованию в статье на Мария-Косметолог.
Мицеллы (уменьшительное от лат. mica «частица, крупинка») — это агрегаты поверхностно-активных веществ (ПАВ) в коллоидном растворе (золе), состоящие из большого количества амфифильных молекул. Как пример можно привести мицеллы додецилсульфата в воде. Раствор ПАВ, в котором мицеллы находятся в равновесии с одиночными неассоциированными молекулами — мономерами — называется мицеллярным раствором.

Переход к мицеллообразованию
Переход к мицеллообразованию происходит в узком интервале концентраций, и его можно трактовать как фазовый переход 2-го рода. Причиной мицеллообразования в водных растворах является гидрофобный эффект, а в средах из неполярных молекул — взаимное притяжение полярных групп молекул ПАВ. Ниже определённой температуры (точки Крафта) образование мицелл не происходит, а при увеличении концентрации ПАВ наблюдается кристаллизация. При приближении концентрации ПАВ к критической концентрации мицеллообразования происходит резкое изменение свойств раствора: электропроводности, поверхностного натяжения, коэффициента рассеяния света и т. д.
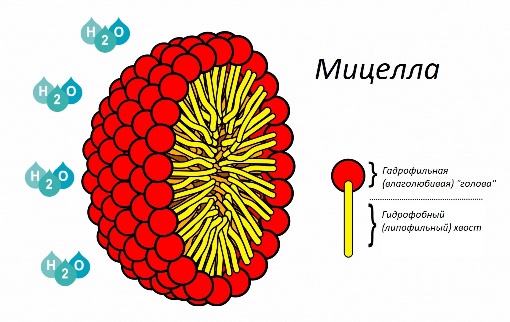
Свойства мицелл
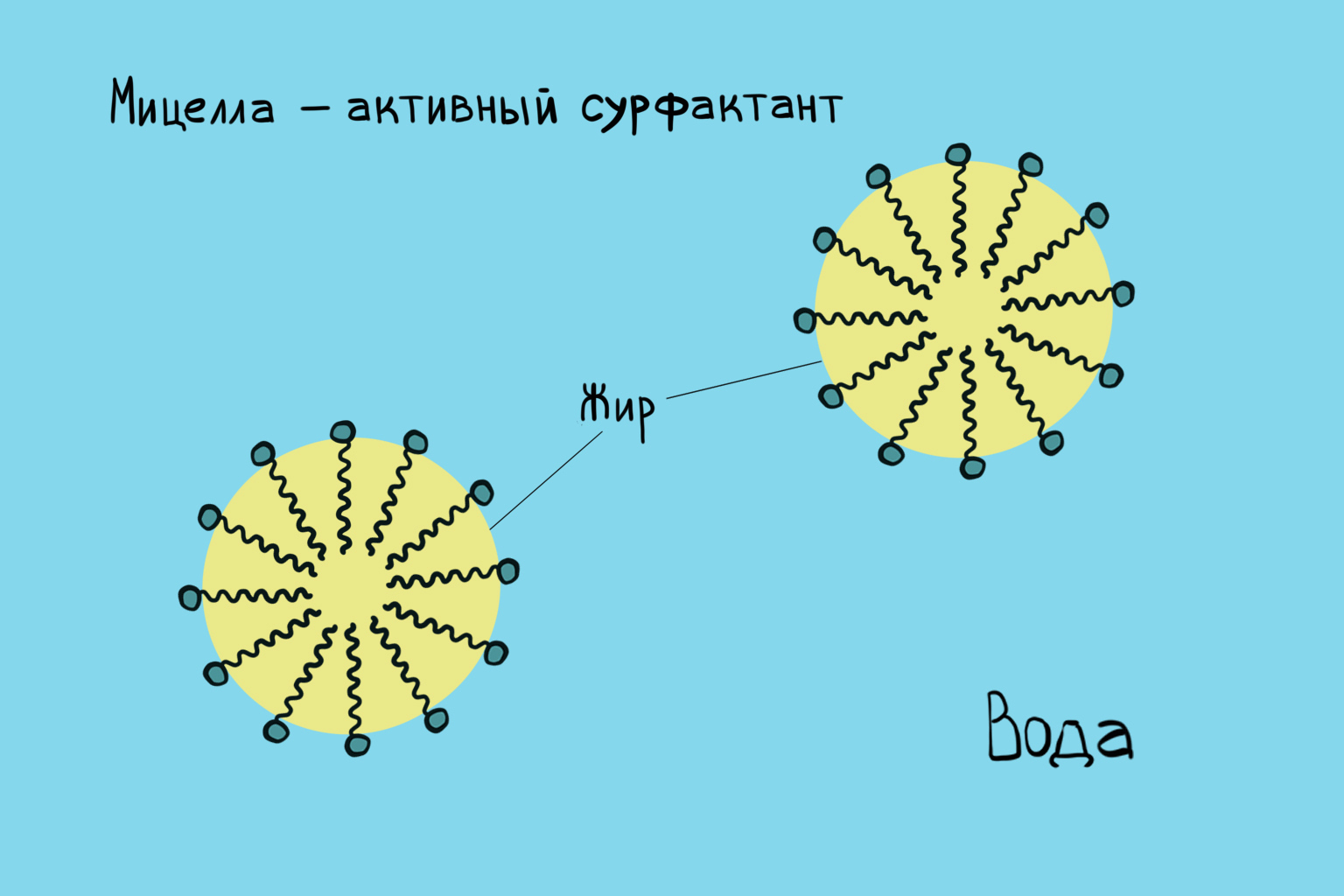
Мицеллярные системы вызывают большой интерес как с точки зрения различных физико-химических технологических приложений (см., например, мицеллярный катализ), так и своеобразия самого механизма мицеллообразования. В частности, этот интерес связан с полиморфизмом мицелл — способностью молекул ПАВ образовывать агрегаты различной формы — сферической, цилиндрической, нитевидной. Одним из важных свойств, вытекающим непосредственно из строения молекул ПАВ, является солюбилизация. Применение свойства солюбилизации — это эмульсионная полимеризация, изготовление пищевых продуктов, получение фармацевтических препаратов.
См. также
История
Способность молекул ПАВ в растворе образовывать мицеллы известна уже более ста лет и широко применяется в современном мире. Первую работу по этой теме в начале 20 века выполнил канадский химик Джеймс Уильям МакБейн. Уже в 1913 году он постулировал существование мицелл для объяснения хорошей электролитической проводимости растворов пальмитиновой кислоты. Тем не менее, основы теоретического описания кинетики мицеллообразования были заложены значительно позже — в 1970-х годах — в работах Анианссона. За последние семнадцать лет кинетическая теория мицеллообразования была значительно расширена, углублена и представлена в терминах теории агрегационных процессов на основе разностных и континуальных кинетических уравнений Беккера-Дёринга и обобщенных кинетических уравнений Смолуховского.

Применение
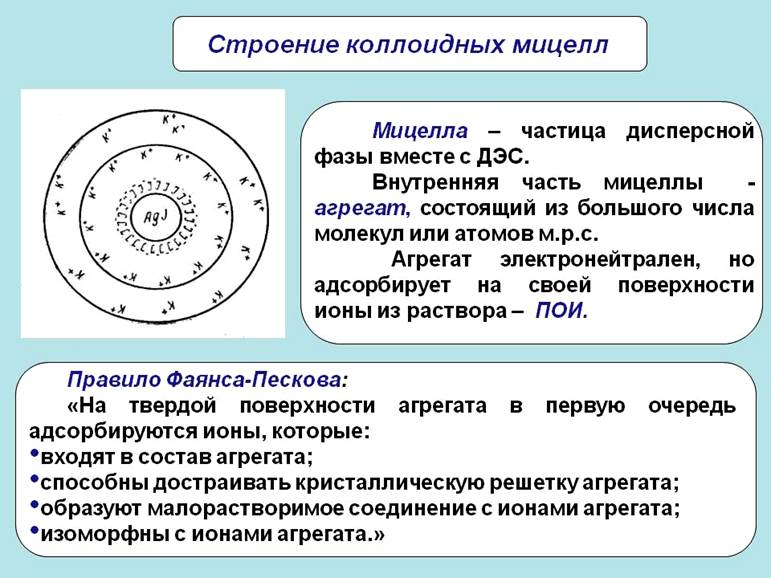
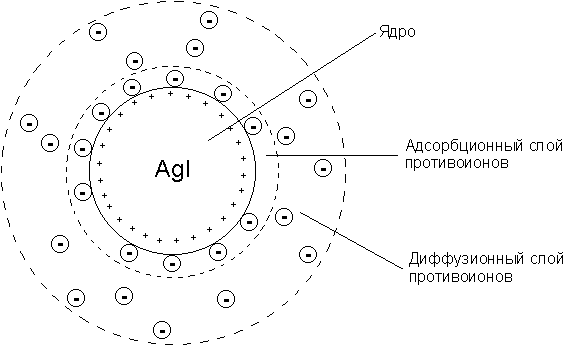
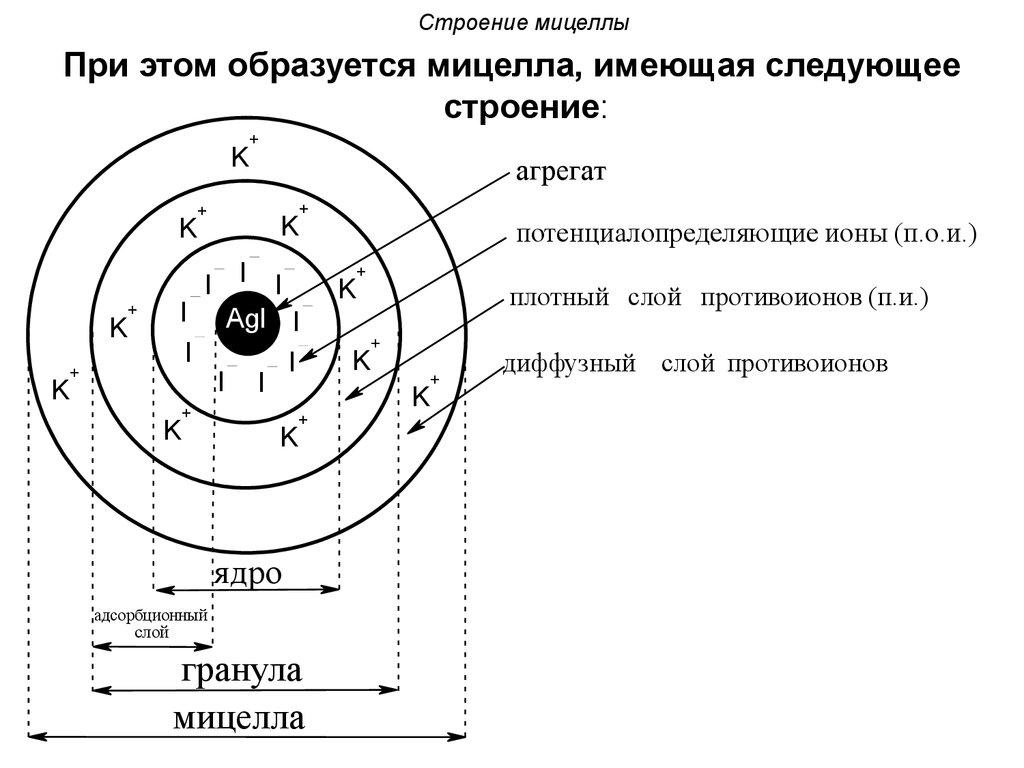
Мицелла (новолат. micella, уменьшительное от лат. mica — крошка, крупинка), отдельная частица дисперсной фазы золя, т. е. высокодисперсной коллоидной системы с жидкой дисперсионной средой. М. состоит из ядра кристаллической или аморфной структуры и поверхностного слоя, включающего сольватно связанные (см. Сольватация) молекулы окружающей жидкости. Поверхностный слой М. лиофобного золя (см. Лиофильные и лиофобные коллоиды) образован адсорбированными молекулами или ионами стабилизирующего вещества. В случае лиофобных гидрозолей, стабилизованных электролитами, ядро М. окружено двумя слоями противоположно заряженных ионов, т. н. двойным электрическим слоем. Число положительных и отрицательных зарядов в нём одинаково, и поэтому М. в целом электронейтральна.
Непосредственно у поверхности ядра расположены ионы адсорбционного слоя. В него входят все ионы одного знака и часть ионов другого знака (противоионы). Остальные противоионы образуют диффузный слой; он окружает М. в виде ионного «облака», плотность которого падает по мере удаления от ядра. Диффузный слой препятствует сближению и агрегированию (сцеплению) частиц в процессе броуновского движения.
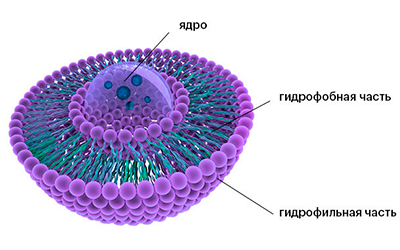
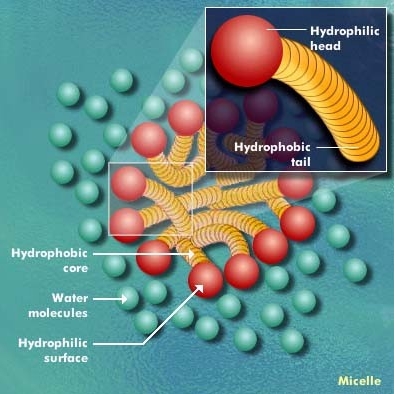
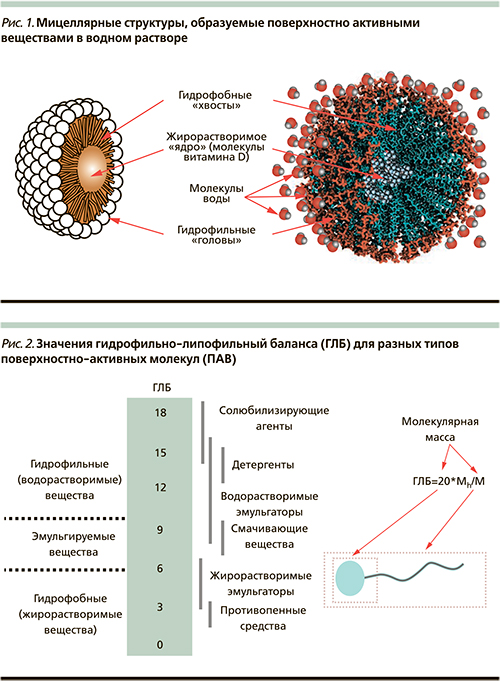
В лиофильных золях, коллоидных дисперсиях типа гидрозолей мыл, например олеата натрия или лаурилсульфата калия, М. представляет собой ассоциат (объединение) молекул. В каждой такой молекуле длинный углеводородный (гидрофобный) радикал связан с полярной (гидрофильной) группой. При образовании М. несколько десятков или сотен молекул объединяются так, что гидрофобные радикалы образуют ядро (внутреннюю область), а гидрофильные группы — поверхностный слой М. Если дисперсионной средой является органическая жидкость, ориентация молекул в М. может быть обратной: в ядре сосредоточатся полярные группы, тогда как гидрофобные радикалы будут обращены во внешнюю фазу. Изобразив молекулу мицеллообразующего вещества в виде волнистой линии (гидрофобный радикал) с кружочком на конце (гидрофильная группа), можно представить простейшие структурные типы М. схемами:
| Мицеллярные структуры |
|---|
| 1. Гидрофильные сферические М. |
| 2. Гидрофильные пластинчатые М. |
| 3. Органофильные сферические М. |
| 4. Органофильные пластинчатые М. |
Сферические М. при разбавлении системы ниже критической концентрации мицеллообразования обратимо распадаются на отдельные молекулы или димеры. При более высоких концентрациях сферические М. превращаются в пластинчатые. Последние, взаимодействуя между собой, способны создавать в объёме системы структурную сетку геля.
Средний размер мицелл составляет от 1 до 100 нм.
Мицеллы являются основой для различных физико-химических технологических приложений, таких как мицеллярный катализ, эмульсионная полимеризация, производство пищевых продуктов и получение фармацевтических препаратов.

Что нам скажет Википедия?
Мицеллы (уменьшительное от лат. mica «частица, крупинка») — это агрегаты поверхностно-активных веществ (ПАВ) в коллоидном растворе (золе), состоящие из большого количества амфифильных молекул. Как пример можно привести мицеллы додецилсульфата в воде. Раствор ПАВ, в котором мицеллы находятся в равновесии с одиночными неассоциированными молекулами — мономерами — называется мицеллярным раствором.
Переход к мицеллообразованию происходит в узком интервале концентраций, и его можно трактовать как фазовый переход 2-го рода. Причиной мицеллообразования в водных растворах является гидрофобный эффект, а в средах из неполярных молекул — взаимное притяжение полярных групп молекул ПАВ. Ниже определённой температуры (точки Крафта) образование мицелл не происходит, а при увеличении концентрации ПАВ наблюдается кристаллизация. При приближении концентрации ПАВ к критической концентрации мицеллообразования происходит резкое изменение свойств раствора: электропроводности, поверхностного натяжения, коэффициента рассеяния света и т. д.
Мицеллярные системы вызывают большой интерес как с точки зрения различных физико-химических технологических приложений (см., например, мицеллярный катализ), так и своеобразия самого механизма мицеллообразования. В частности, этот интерес связан с полиморфизмом мицелл — способностью молекул ПАВ образовывать агрегаты различной формы — сферической, цилиндрической, нитевидной. Одним из важных свойств, вытекающим непосредственно из строения молекул ПАВ, является солюбилизация. Применение свойства солюбилизации — это эмульсионная полимеризация, изготовление пищевых продуктов, получение фармацевтических препаратов.