Силициловая кислота - низкомолекулярное органическое соединение с противовоспалительными, отшелушивающими и антиоксидантными свойствами. Узнайте, как эта кислота применяется в косметологии и медицине для борьбы с акне, фотостарением и другими проблемами кожи. Лучшие советы и рекомендации от Марии-Косметолог.
Cодержание
Введение
Силициловая кислота, также известная как 2-гидроксибензойная или фенольная кислота, является низкомолекулярным органическим соединением. Она представляет собой бесцветные кристаллы, хорошо растворимые в этаноле, диэтиловом эфире и других полярных органических растворителях, но плохо растворима в воде (1,8 г/л при +20 °C). Салициловая кислота была выделена из коры ивы и встречается в природе в растениях в виде производных. Она имеет широкий спектр применения в медицине и косметологии благодаря своим противовоспалительным, отшелушивающим и антиоксидантным свойствам.

Выделение и синтез
Салициловая кислота впервые была выделена итальянским химиком Рафаэлем Пириа из коры ивы. В природе она также встречается в виде гликозида метилового эфира. Синтез салициловой кислоты осуществляется по реакции Кольбе-Шмитта из фенолята натрия и углекислого газа при высокой температуре и давлении с последующей обработкой продукта реакции соляной кислотой.

Физические и химические свойства
Салициловая кислота легкорастворима в этаноле, диэтиловом эфире и малорастворима в сероуглероде. Она является двухосновной кислотой и обладает слабой реакционной способностью бензольного ядра. Ее электрофильное замещение направлено в орто- и пара-положения к гидроксильной группе и часто сопровождается декарбоксилированием.
См. также
Применение в косметологии
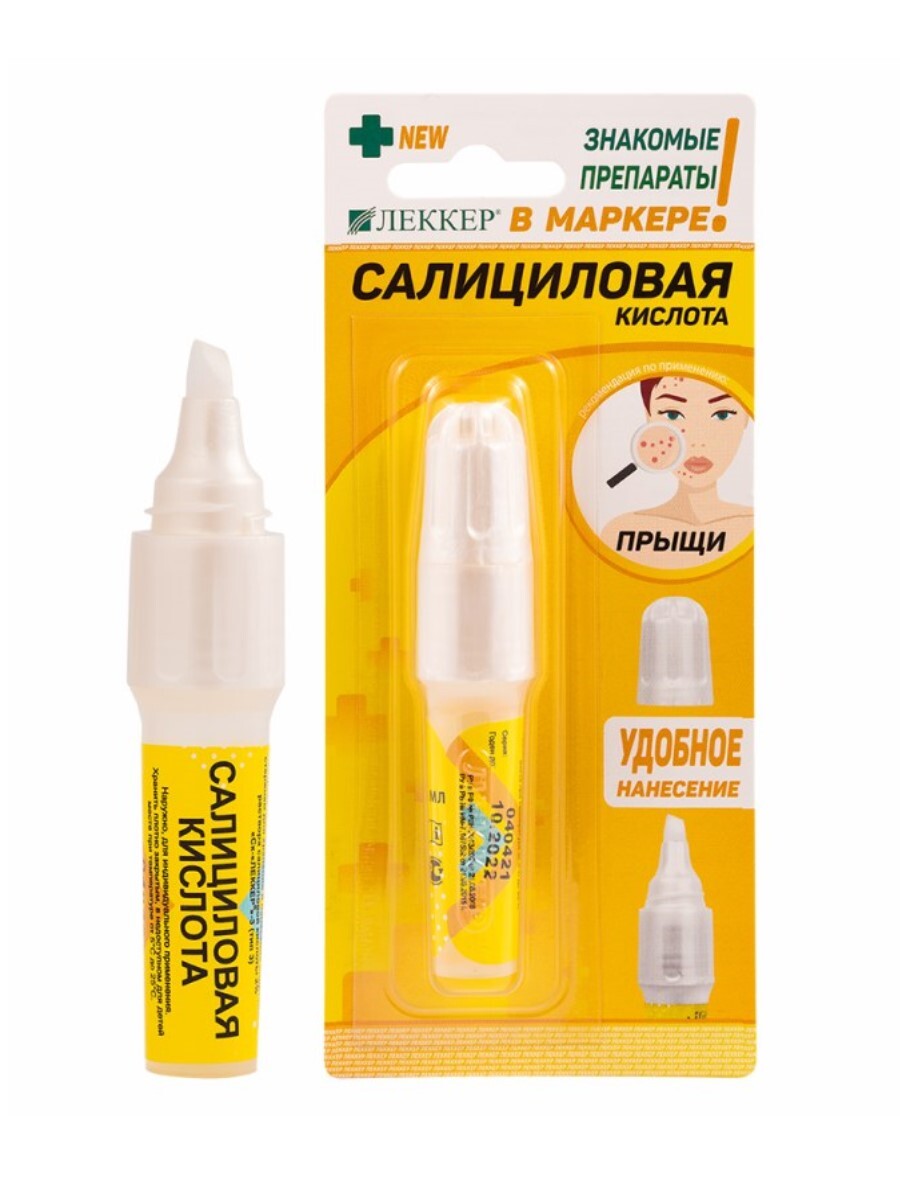
Салициловая кислота относится к группе BHA-кислот и широко используется в косметологии благодаря своим противовоспалительным, отшелушивающим, антиоксидантным и противозудным свойствам. Она эффективно борется с проблемами кожи, такими как акне, черные точки, покраснения и фолликулярный кератоз. Салициловую кислоту можно применять локально на воспаленные участки кожи или на всё лицо, особенно в Т-зоне, где активно вырабатывается себум.
Салициловая кислота не фоточувствительна и может использоваться в любое время года. Она не сочетается с высокой концентрацией витамина С и АНА-кислотами. При использовании салициловой кислоты с ретинолом следует быть осторожными, так как оба активных вещества имеют агрессивное воздействие на кожу.

Применение в медицине
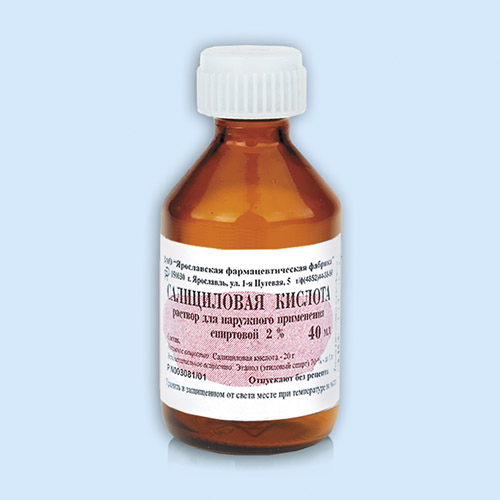
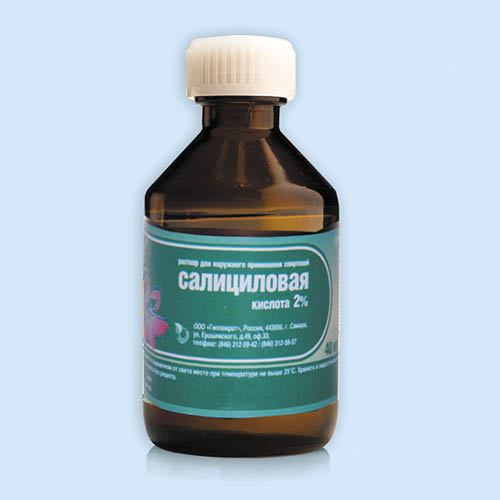
Салициловая кислота широко применяется в медицине в качестве лекарственного антисептического препарата. Она обладает кератолитическим, противовоспалительным и противомикробным действием. Применяется для лечения псориаза, прыщей, черных точек и для обработки ран с ожогами. Салициловая кислота также используется в виде спиртового раствора с низкой стоимостью и эффективно борется с различными дефектами кожного покрова.

Пилинги с салициловой кислотой
Салициловая кислота часто применяется в пилингах в сочетании с гликолевой кислотой. Пилинг с салициловой кислотой может быть проведен для лечения акне, фотостарения, постакне, себорейного дерматита и демодекоза. Пилинг наносится на кожу на несколько минут, затем снимается ватным диском и поверхность кожи промывается теплой водой.
См. также
Можно ли проткнуть иглой подкожный прыщ?
Заключение
Салициловая кислота является значимым органическим соединением с многообразными свойствами и применением в медицине и косметологии. Ее противовоспалительные, отшелушивающие и антиоксидантные свойства делают ее эффективным ингредиентом для ухода за проблемной кожей и лечения различных дерматологических проблем.
Что нам скажет Википедия?
Салици́ловая кислота́ (от лат. salix «ива», из коры которой она была впервые выделена) — низкомолекулярное органическое соединение, 2-гидроксибензойная или фенольная кислота. Бесцветные кристаллы, хорошо растворима в этаноле, диэтиловом эфире и других полярных органических растворителях, плохо растворима в воде (1,8 г/л при +20 °C).
Выделена из ивовой коры итальянским химиком Рафаэлем Пириа и затем синтезирована им же.
Распространение в природе
В природе встречается в растениях в виде производных — главным образом в виде гликозида метилового эфира (в частности, салициловая кислота была впервые выделена из коры ивы, откуда и происходит название), свободная салициловая кислота наряду с салициловым альдегидом в небольших количествах содержится в эфирном масле, выделяемых из цветов некоторых видов спиреи (Spiraea ulmaria, Spiraea digitata).
Синтез
Салициловую кислоту получают по реакции Кольбе — Шмитта из фенолята натрия и углекислого газа в автоклавах при 180 °С с последующей обработкой продукта реакции соляной кислотой:
Физические свойства
Салициловая кислота легкорастворима в этаноле, диэтиловом эфире, малорастворима в сероуглероде. Растворимость в воде (г/л): 1,2 (0 °C), 1,8 (20 °C), 8,2 (60 °C), 20,5 (80 °C).
Химические свойства
Является двухосновной кислотой (очень слабой по второй ступени): pK1 = 2,97 pK2 = 13.82.
Реакционная способность бензольного ядра салициловой кислоты определяется наличием двух заместителей с противоположными мезомерным и индуктивным эффектами: донорной гидроксильной и акцепторной карбоксильной: в результате салициловая кислота значительно легче бензойной, но не так активно, как фенол, вступает в реакции электрофильного замещения вследствие стабилизации промежуточного σ-комплекса гидроксильной группой.
Электрофильное замещение направляется в орто- и пара-положения к гидроксилу и зачастую сопровождается декарбоксилированием: так, нитрование салициловой кислоты приводит к пикриновой кислоте (2,4,6-тринитрофенолу), а бромирование — к 2,4,6-трибромфенолу, хотя сульфирование олеумом идёт без декарбоксилирования и даёт сульфосалициловую (2-гидрокси-5-сульфобензойную) кислоту.
При нагревании салициловая кислота декарбоксилируется до фенола, в промышленности салициловую кислоту обычно получают обратной реакцией — карбоксилированием фенолята натрия углекислым газом при 150—180 °C и давлении 5 атм (реакция Кольбе — Шмитта):
Следует обратить внимание, что такое карбоксилирование фенола, во-первых обратимо и, во-вторых, существенную роль в карбоксилировании в орто-положение к фенольному гидроксилу играет эффект взаимодействия координационной связи катиона щелочного металла с кислородными лигандами с образованием хелатообразного промежуточного состояния: так, в орто-положение с образованием салицилата карбоксилирование происходит только в случае фенолятов натрия и лития, в случае фенолятов калия, рубидия и цезия карбоксилирование идёт по пара-положению — катионы этих щелочных металлов имеют больший радиус и координационная стабилизация переходного состояния невозможна. Об обратимости реакции говорит также перегруппировка дикалиевой соли салициловой кислоты в дикалиевую соль пара-гидроксибензойной кислоты и превращение натриевой соли пара-гидроксибензойной кислоты при нагревании в динатриевую соль салициловой кислоты.
Такое хелатообразование характерно для салициловой кислоты — так, качественный метод обнаружения салициловой кислоты основан на образовании интенсивно окрашенных в сине-фиолетовый цвет комплексов с хлоридом железа (III).
Каталитическое гидрирование на платине, а также восстановление натрием в изоамиловом спирте ведёт к пимелиновой кислоте HOOC(CH2)5COOH.
Салицилаты
Салициловая кислота образует соли — салицилаты. Некоторые представители:
Физиологическая роль и действие салицилатов
Действие на человека и животных
Салициловая кислота и салицилаты, а также её сложные эфиры (метилсалицилат) и другие синтетические производные салициловой кислоты (например, ацетилсалициловая кислота — аспирин), обладают выраженным противовоспалительным действием.
Гормон растений
Показано действие салициловой кислоты как фитогормона. Салициловая кислота вызывает повышение температуры в отдельных органах термогенных растений (в частности у некоторых представителей семейства Ароидных). Это происходит по причине разрыва транспорта электронов в митохондриальной дыхательной цепи. Активно изучается роль салициловой кислоты в развитии неспецифической реакции на стрессогенные факторы и накопление в клетках активных форм кислорода.
Применение салициловой кислоты
Применение в медицине
Салициловая кислота — активный компонент ивовой коры. Ещё в XIX в. её использовали для лечения ревматизма и мочекислого диатеза, а сегодня это вещество синтезируют в больших количествах, так как оно служит основой для производства многих лекарств.
Салициловая кислота обладает слабыми антисептическими, раздражающими и кератолитическими (в больших концентрациях) свойствами и применяется в медицине наружно в мазях и растворах при лечении кожных заболеваний; входит в состав пасты Лассара, присыпки «гальманин», препаратов «мозольная жидкость» и «мозольный пластырь». В аптечной сети продаётся в таких лекарственных формах, как спиртовой раствор для наружного применения, известный в народе как «салициловый спирт» (с содержанием салициловой кислоты 1 или 2 %) и мазь (2, 3, 5 и 10-процентная).
Производные салициловой кислоты также применяются в медицине: амид (салициламид) и уксуснокислый эфир (ацетилсалициловая кислота) используют как жаропонижающие, противоревматические, противовоспалительные и болеутоляющие средства; фенилсалицилат — как антисептик; пара-аминосалициловую кислоту (структурно близкую с пара-аминобензойной кислотой, необходимой туберкулезным микобактериям, и поэтому метаболически конкурирующую с ней) — как специфическое противотуберкулёзное средство.
Другие сферы применения
Токсические свойства и требования безопасности
Салициловая кислота токсична в больших дозах, для человека предполагаемая LD50 составляет 1,75 г/кг. Беременным советуют не употреблять продуктов, содержащих салицилаты, из-за повышения риска развития синдрома Рея.
В организме человека салициловая кислота метаболизируется, образуя конъюгаты с глюкуроновой кислотой (о-гидроксибензоилглюкуронид и о-карбоксифенилглюкуронид) и глицином, либо путём гидроксилирования до 2,3- и 2,5-дигидроксибензойной и 2,3,5-тригидроксибензойной кислот. Салициловая кислота и её метаболиты выводятся из организма с мочой.