Узнайте, почему водородный показатель (pH) не может быть больше 14. Разберемся в механизме измерения pH и его значениях. Узнайте, как определить pH растворов и как калибровать pH-метр. Изучите важность регулирования pH в различных областях науки и промышленности.
Cодержание
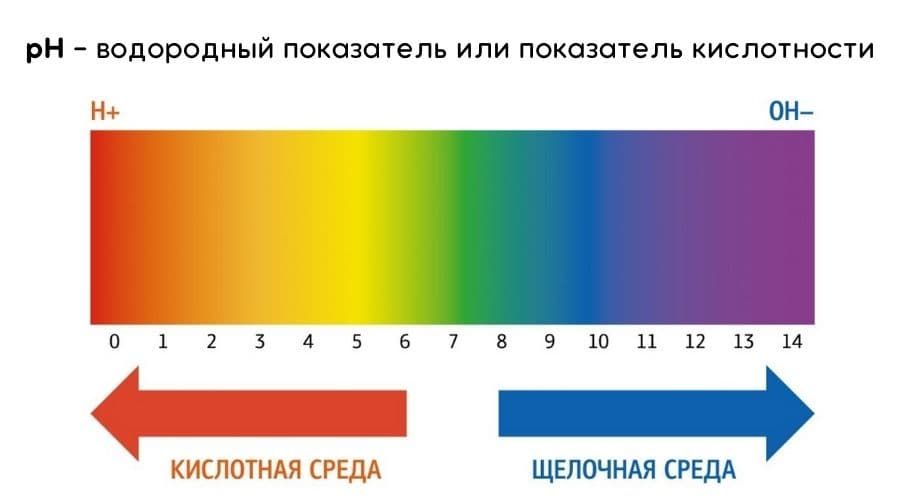
Водородный показатель (pH-фактор) является мерой активности ионов водорода в растворе и количественно выражает его кислотность. Обычно значение pH лежит в пределах от 0 до 14 при стандартных условиях. В чистой воде при нейтральном pH концентрация ионов водорода равна концентрации гидроксид-ионов и составляет 1·10^-7 моль на литр. Максимальное значение pH определяется как сумма pH и pOH и равно 14.
Однако, вопреки распространенному мнению, pH может изменяться не только в интервале от 0 до 14, но и выходить за эти пределы. Например, при концентрации ионов водорода [H+] = 10^-15 моль/л, pH = 15, а при концентрации ионов гидроксида [OH-] = 10 моль/л, pOH = -1.
Кислотно-основные индикаторы
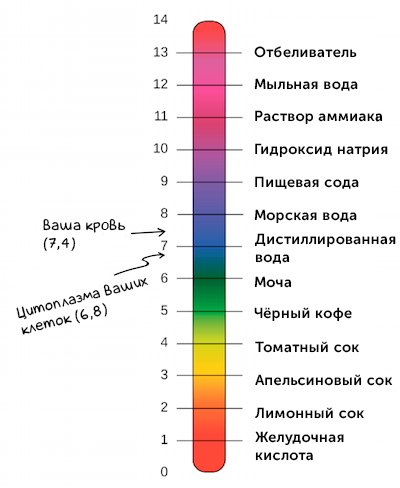
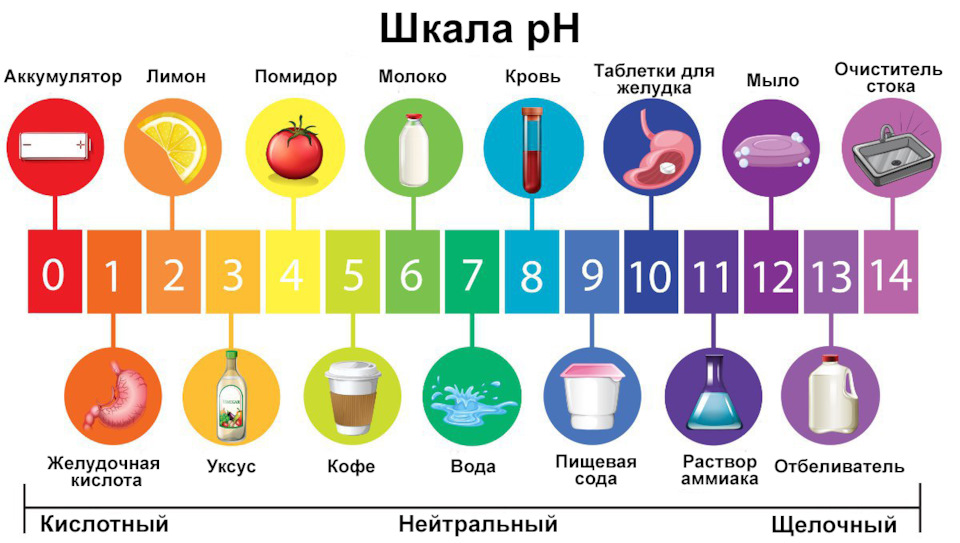
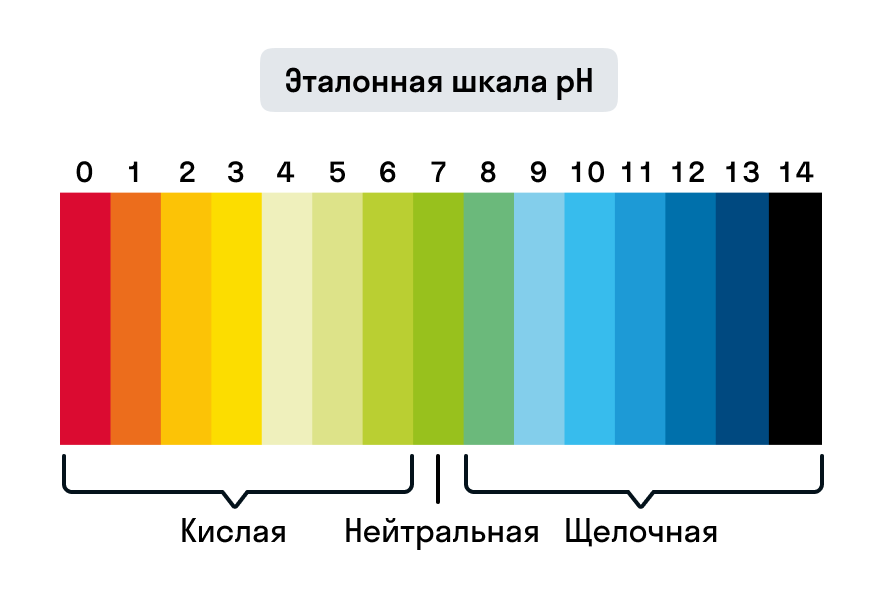
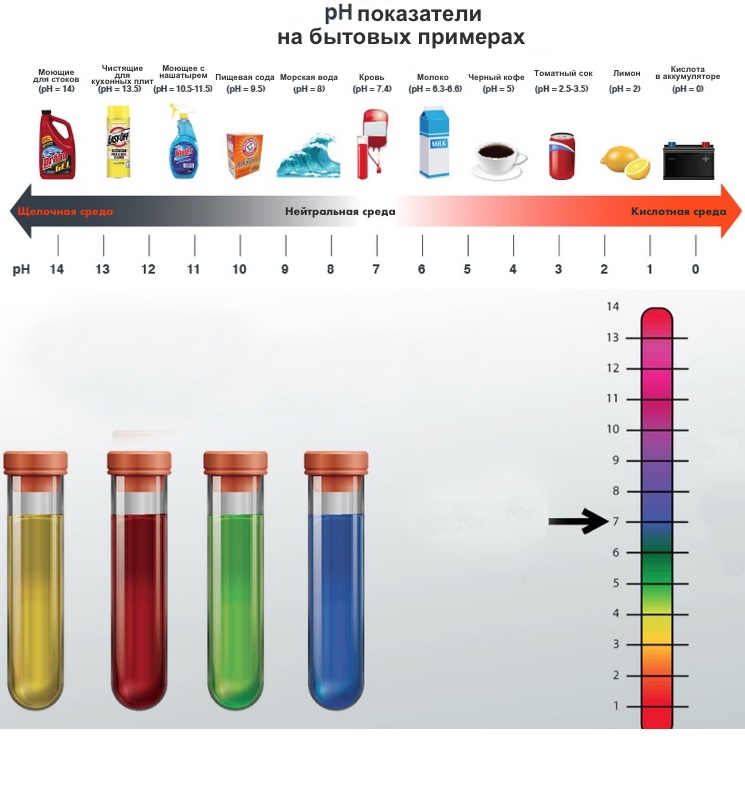
Для грубой оценки концентрации водородных ионов широко используются кислотно-основные индикаторы - органические вещества-красители, цвет которых зависит от pH среды. Некоторые из известных индикаторов включают лакмус, фенолфталеин и метиловый оранжевый.
Определение значения pH
Значение pH растворов можно приближенно оценить с помощью индикаторов, точно измерить с помощью pH-метра или определить аналитически путем кислотно-основного титрования.
Точное измерение и регулирование pH является необходимым в различных отраслях химии, биологии, наук о материалах, технологий, медицины и агрономической химии.
История
Понятие pH было введено в 1909 году датским химиком Сёренсеном. Показатель называется pH, по первым буквам латинских слов "potentia hydrogenii" - сила водорода, или "pondus hydrogenii" - вес водорода.
Уравнения, связывающие pH и pOH
В чистой воде концентрации ионов водорода ([H+]) и гидроксид-ионов ([OH-]) одинаковы и при 22 °C составляют 10^-7 моль/л. Поэтому при этой температуре pH + pOH = 14.
Концентрации ионов водорода и гидроксид-ионов влияют на кислотность или щелочность раствора. Когда [H+] > [OH-], раствор является кислотным, а при [OH-] > [H+], раствор является щелочным.
Калибровка pH-метра
Калибровка pH-метра подразумевает сравнение его показаний с лабораторно сертифицированным стандартным буферным раствором. Буферные растворы используются для настройки прибора на определенные значения pH. Например, для измерения кислотных растворов используется буферный раствор с pH 4, а для измерения нейтральных растворов - с pH 7.
Калибровка pH-метра необходима для достижения точности результатов измерений и поддержания прибора в рабочем состоянии.
Заключение
Водородный показатель (pH) является важной химической характеристикой, которая определяет кислотность или щелочность раствора. При стандартных условиях pH лежит в диапазоне от 0 до 14. Однако, существуют растворы, в которых pH может быть выше 14 или ниже 0. Точное измерение и регулирование pH является необходимым для различных областей науки и промышленности.

Что нам скажет Википедия?
В чистой воде концентрации ионов водорода ([H+]) и гидроксид-ионов ([OH−]) одинаковы и при 22 °C составляют по 10^-7 моль/л, это напрямую следует из определения ионного произведения воды, которое равно [H+] · [OH−] и составляет 10^-14 моль^2/л^2 (при 25 °C).
Когда концентрации обоих видов ионов в растворе одинаковы, говорят, что раствор имеет нейтральную реакцию. При добавлении к воде кислоты концентрация ионов водорода увеличивается, а концентрация гидроксид-ионов соответственно уменьшается, при добавлении основания наоборот, повышается содержание гидроксид-ионов, а концентрация ионов водорода падает. Когда [H+] > [OH−], говорят, что раствор является кислотным, а при [OH−] > [H+] — основным.
Так как при 25 °C (стандартных условиях) [H+] · [OH−] = 10^-14, то понятно, что при этой температуре pH + pOH = 14.
Так как в кислотных растворах [H+] > 10^-7, то у кислотных растворов pH < 7, аналогично, у основных растворов pH > 7, pH нейтральных растворов равен 7.
При более высоких температурах константа электролитической диссоциации воды повышается, соответственно увеличивается ионное произведение воды, поэтому нейтральной оказывается pH < 7 (что соответствует одновременно возросшим концентрациям как H+, так и OH−); при понижении температуры, напротив, нейтральная pH возрастает.